
20. BÖLÜM : Köprü Kemoterapisi: Yetişkinde Akut Lenfoblastik Lösemi
Nicolas Boissel ve Fabio Ciceri
Köprü tedavisi CAR-T hücresi üretimi sürecinde lökoferezden sonra ve lenfodeplesyondan önce uygulanabilir. Köprü tedavilerinde ana amaç, altta yatan hastalığın CAR-T üretimi sırasında kontrolsüz bir şekilde ilerlemesini engellemektir. Birçok çalışma, tümör yükü arttıkça CAR-T nakli sonrasında komplikasyon riskinin arttığını göstermiştir (Cohen ve ark. 2019). Bu sebeple, kök hücre üretimi sürecinde hastalığı kontrol etmek ya da tümör yükünü azaltmak, kritik öneme sahiptir. Sürecin başarısı için uygun bir köprü kemoterapisinin seçilmesi gereklidir.
Klinik çalışmalar, B-ALL hastalığı için CD19 CAR-T tedavisinde yüksek hasta devamsızlığı olduğunu tekrarlanabilir bir şekilde göstermiştir. Tedaviyi bırakma sebebi hastalığın ilerlemesi ya da tedaviyle alakalı komplikasyonlar olabilmektedir (Park ve ark. 2018; Maude ve ark. 2018). Örneğin, ELIANA çalışması kapsamında CAR-T nakli yapılan 75 hastadan, 65 (%87) tanesi tedavi başlangıcı ile kök hücre nakline kadarki süreçte köprü kemoterapisi alırken, nakil için kaydolan 92 hastanın 10 tanesine ciddi yan etkiler veya hastanın ölümü sebebiyle kök hücre nakli yapılamamıştır (Maude ve ark. 2018). Memorial Sloan Kettering (MSKCC) deneyinde ise, yan etkilere veya hastanın ölümüne bağlı olarak, tedaviye kayıt yaptıran ancak nakil sürecini tamamlayamayan yetişkin hastaların oranı %65 (54/83) olarak ölçülmüştür (Park ve ark. 2018). Bu durum, otolog CAR-T hücresi hazırlanması için gerekli 3-6 haftalık dönemin yönetiminde karşılaşılan klinik zorlukları göstermektedir.
Şu anda CAR-T tedavisi; tekrarlayan/tedaviye dirençli kansere sahip, ve halihazırda bir ya da birden fazla etkililiği muhtemel yaklaşıma yanıt vermemiş B-ALL hastalarına önerilmektedir. Tümör yükü fazla ve ilerleyici eğilimi yüksek bu vakaların müdahaleye ihtiyacı genellikle fazla olduğundan, daha etkili bir yaklaşım seçeneği büyük öneme sahiptir.
Köprü tedavisi olarak; kuvvetli kemoterapi, hedefe yönelik kanser ilaçları (ör. tirozin kinaz inhibitörleri), immünoterapiler (ör. CD-19 veya CD22’ye yönelik) ve düşük şiddetli yaklaşımlar (ör. vinkristin, 6-MP, steroidler, tioguanin vb.) gibi çeşitli seçenekler günümüzde mevcuttur. Kuvvetli kemoterapinin CAR-T hücrelerinin çoğalması için fazla toksik olabilmesi, düşük şiddetli yaklaşımların ise tümör yükünü azaltmada etkisinin yeterli olmama potansiyelinin olması örneklerinden yola çıkılarak her yaklaşımın artıları ve eksileri olduğu söylenebilir.
Buna ek olarak bispesifik T hücre engager (BİTE) blinatumomab gibi CD19 hedefli tedavilerin uygulanması, daha sonra uygulanacak CD19 CAR-T tedavisinin verimliliğini etkileyebilir (Pillai ve ark. 2019). CD19 hedefli tedaviye rağmen tümör kaçışlarının olduğu da bilinmektedir, bu tümör kaçışlarının yaygın mekanizmaları çalışmalarda gösterilmiştir(Boissel 2021). Benzeri çalışmalarda hastaların blinatumomab kullanımına izin verilse de ELIANA çalışmasında bu durum bir dışlama kriteri olarak gösterilmiştir (Maude ve ark. 2018). Genişletilmiş tisagenlecleucel erişimi programında, daha önce blinatumomab kullanan hastaların tedaviye cevap oranı %67 iken diğer hastalarda bu oran %90’dır (Baruchel ve ark. 2020). Ancak günümüz şartlarında bu önemli kurtarma seçeneği ile ilgili kesin veri bulunmamaktadır.
Yakın zamanda yapılan bir çalışmada Memorial Sloan Kettering grubu, R/R yetişkin ALL’den muzdarip, tek merkezli faz 1 bir CD19 spesifik CAR-T çalışmasına gönüllü olan tüm hastalar için farklı köprü stratejilerini ve sonuçlarını gözden geçirmiştir (ClinicalTrials.gov NCT01044069) (Perica ve ark. 2019). Köprüleme döneminde hastalık yükünün azalmasının CAR-T tedavisi sonrasında daha olumlu sonuçlarla ilişkili olduğunu, bu sebeple köprü döneminde hastalık yükünü azaltmaya yönelik uygun stratejilerin kullanılmasının gerekli olduğu bu çalışmada vurgulanmıştır. Çalışmanın sonuçlarına göre araştırmacılar, köprüleme stratejisinin CAR-T tedavisinin başlangıcındaki hastalık yüküne göre kurgulanmasını önermişlerdir. Düşük tümör yüküne sahip hastalar için düşük şiddetli tedaviler, tedaviye dirençli ve yüksek tümör yüküne sahip hastalar için ise düşük şiddetli kemoterapi ya da hedefe yönelik kanser ilaçları (örn. inotuzumab) da öneriler arasındadır. Araştırmacılar yüksek hastalık yüküne sahip ve kemosensitivite (örn. önceki uygulanan kemoterapiye parsiyel ya da kısa süreli cevap verme) olasılığı olan hastalar için yüksek ve düşük şiddetli tedavilerin risklerinin ve olası faydalarının dikkatli bir şekilde karşılaştırılmasını da tavsiye etmişlerdir. Beklendiği üzere çalışmanın köprü tedavisi olarak yüksek şiddetli kemoterapi kullanan grubunda daha yüksek bir enfeksiyon oranı saptanmıştır.
Sonuç olarak uygun köprü tedavisi; tümör yükü, hasta komorbiditeleri ve hastalığın karakteristiğine göre seçilmelidir. Köprü tedavisinin amacı hastalığı tamamen yok etmek değil, tümör yükünü azaltmak ve hastanın klinik açıdan iyilik halini CAR-T enjeksiyonuna kadar sürdürmek olmalıdır. Tümör yükünün azaltılmasından, (1) erken yan etki (örn. sitokin salınım sendromu) riskini azaltması ve (2) CAR-T tedavisi sonrasında daha iyi bir sonuca yol açması gibi etkileri sebebiyle iki kat fayda elde edilebilir. B hücre hedefli tedavilerin rolü, özellikle CAR-T hücre aktivitesine olumsuz etkisi açısından, daha derin bir araştırma gerektirse de; hedefe yönelik ve düşük şiddetli tedavi yaklaşımları bu amaca yardımcı olabilir. CAR-T tedavisi bağlamındaki yüksek şiddetli kemoterapi kullanımı ise, tümör yükünün hızla azaltılmasının enfeksiyon riskindeki artıştan daha önemli olduğu durumlarla sınırlandırılmalıdır.
Önemli Noktalar:
21.BÖLÜM : ÇOCUKLARDA,ERGENLERDE VE GENÇ YETİŞKİNLERDE CAR-T HÜCRELERİYLE KÖPRÜLEME
Andre Baruchel
KÖPRÜLEMENİN ÖNEMİ
Bebekler de dahil olmak üzere çoğu hastada lökoferez yapılabilir ancak tüm hastalarda otolog CART-T hücreleri kullanılmaz.ELIANA Deneyi sorunların anlaşılmasına yardımcı olmak için incelenebilir. Deneyde 97 hasta başarıyla tarandı ve kaydedildi.Bunlardan yalnızca 79 u sonunda infüzyona geçti.Kalan 18 hastadan 10 u üretim sürecinde öldü veya AE yaşadı. 8 hasta da üretim süreciyle ilgili sorunlar yaşadı.(Grupp et al.2018)
Allojenik hematopoietik hücre transplantasyonunda(allo-HCT) öncelik beklenenin aksine optimal bir köprüleme tedavisinin rolü en düşük rezidüel hastalığı elde etmek değil sadece tümör yükünü azaltmak veya stabilize etmek ve hastayı iyi klinik durumda CAR-T hücre infüzyonuna getirmektir.
Hatırlatma:
Not:Taze hücreler ve merkezi olmayan üretim kullanan akademik kapalı sistemlerde üretim daha kısa olabilir.
-Nakliye için kriyoprezervasyon : zaman kaybedilebilir ,üretim yuvalarından etkilenebilir.
-Üretim alanı : ABD veya AB
-Aferez ürününü alacak hücre tedavisi laboratuvarının ve ilacı alacak aynı laboratuvar ve eczanın ortak mevcudiyeti
-Klinikte bir oda bulunması ve komplikasyon durumunda hastanın yoğun bakım ünitesine kabul edilme olasılığı , mevcut pandemide bir sorun olabilir.
-Ana riskler hastalığın ilerlemesi olmak üzere hastalığın seyri ve klinik durumu son derece önemlidir. Ağır şekilde ön tedavi görmüş hastalarda ve kemo/immünoterapiye bağlı diğer SAE lerde enfeksiyon (özellikle mantar hastalıkları) oluşumu riski vardır.(ör.,inotuzumab)
Köprüleme sanatı aşağıdaki adımları içerir:
Olası seçeneklerin örnekleri Tablo 21.1
Tablo 21.1 Tümör yükü , hastalık lokalizasyon ve kinetiğine göre CAR-T hücre tedavisine giden yolda olası köprüleme tedavileri.
THI’ler gibi hedeflenen ajanlar düşük yoğunluklu kemoterapiye ek olarak PH+ ALL ve ABL sınıfı füzyonda kullanılabilir.
EMD: ekstramedüller hastalık
Peki immünoterapi için uygun mu?
Önemli Noktalar:
Bu alanda herkes için tek doğru yoktur. Ayrıntılı hastalık biyolojisi, yükselen hedefler, tedaviye önceki duyarlılık, hastanın tolerans öyküsünün bilinmesi gereklidir.
22. BÖLÜM : KÖPRÜLEME KEMOTERAPİSİ: NÜKSEDEN/ İNATÇI AGRESİF B-HÜCRELİ LENFOMA
“Catherine Thieblemont & Peter Borchmann’’
Nükseden ve İnatçı Agresif B-Hücreli Lenfomada Köprüleme Yapmak ya da Yapmamak
Lökoferez ve CAR-T hücre reinfüzyonu arasındaki zaman aralığı, hücre üretimi döneminde tedavi edilmezse ölümcül olabilen R/R B-hücre lenfomalı hastalar ve semptomatik hastalığı olan birçok hasta için kritik öneme sahiptir. Onkologlar bu ikilemi genellikle steroitler, kemoterapi, hedefe yönelik tedavi veya radyasyon terapisini içerebilen köprüleme tedavisi ile ele alırlar.
Ancak yine de axi-cel onayına yol açan ZUMA-1 çalışmasına dahil edilen R/R DLBCL hastalarının deksametazon dışında BT(bridging therapy, köprüleme terapisi) almasına izin verilmedi. (Neelapu,2017) Aksine sırasıyla JULIET ve TRANSCEND çalışmaları, sistemik terapi, radyasyon terapisi ve her ikisi de dahil olmak üzere çeşitli tedavilere izin verdi.(Schuster,2019; Locke 2019; Abramson 2020) Bu son çalışmalarda araştırmacıların kararı üzerine köprüleme terapisi TRANSCEND’deki 269 hastanın 159’unda(%59) ve JULIET’teki hastaların %92’sinde kullanılmıştır. Daha da önemlisi BT alan hastaların daha agresif hastalığa sahip olması muhtemeldir ve bu sebeple bu hastaların artmış sitokin salım sendromu, nörolojik olaylar ve her ikisi için risk faktörüne- artmış serum laktat dehidrogenaz sevşyesi (LDH), lenfotüketici kemoterapiden önce ürün çapının toplamında artış veya yüksek toplam metabolik tümör yükü(TMTV) ve artan bazal C-reaktif protein seviyesi gibi- sahip olması muhtemeldir.
Gerçek dünya ortamında axi-cel veya tisa-cel ile tedavi edilen hastaların %87’sine BT gerekliydi. (Nastoupil, 2020; Vercellino,2020) Ancak BT çoğu hastada CART’nin yeniden infüzyonu sırasında daha düşük bit tümör yükü gibi bir sonuç vermedi.(Locke 2019)
Hangi Köprüleme Terapisi?
Lökoferez ve infüzyon arasındaki zaman ABD ve Avrupa arasında çeşitlilik gösterebilir. Fransa’da bu süre yaklaşık 50 gün olarak tanımlandı. Köprüleme sırasındaki ortalama döngü sayısı 2’ydi.(1-4 aralık; IQR, 1-2) Köprüleme terapisi, kemo içermeyen dozaj da dahil olmak üzere yüksek yoğunluklu BT ve düşük dozda BT olarak tanımlanan çeşitli immünokemoterapi veya kemoterapi dozajlarından oluşmaktaydı. Lenfoma ilerlemesi nedeniyle, hastaların %31’i 1 sıradan fazla köprüleme tedavisi almıştır. Tablo 22.1 farklı BT seçeneklerini tanımlamaktadır.
Seçim şu seçeneklere dayanılarak yapılır:
Tablo 22.1= Olası Köprüleme Tedavileri
Hiçbir tedavi yok: İlgili tümör kütlesi veya büyümesi olmayan asemptomatik hastalık
Düşük yoğunluklu tedavi: Düşük hastalık yükü için( Etiket kullanımı için, lütfen yerel gereksinimleri kontrol edin)
Yüksek yoğunluklu tedavi: Agresif hastalıklar
Hızlı ilerleyen hastalıklar için çok yüksek yoğunlukta tedavi
Köprüleme Tedavisine ve Onu Takip Eden CAR-T Hücre Terapisine Yanıt Oranı
Klinik denemeler boyunca, köprüleme terapisini alan hastalar da dahil, bütün alt gruplardan objektif yanıtlar alındı.(Locke,2019) BT alan hastalarda uzun süreli yanıtlar da görüldü.(Locke,2019) Yine de gerçek hayatta erken nüksetmeler, yüksek yoğunluklu BT ile ilişkiliydi.(Vercellino,2020) Ayrıca daha yüksek bir tümör yükü ve seçim sırasında hastalarda daha hızlı ilerleyen semptomatik hastalık ile de ilişkiliydi. Benzer şekilde, Nastoupil ve çalışma arkadaşları, axi-cel infüzyonu alan hastalar içinde, köprüleme terapisinin OS ile ilişkili olmadığını, ancak özellikle sistemik BT alanlar içerisinde PFS’yi olumsuz etkilemiş olabileceğini gösterdi. İlginç bir şekilde, karşılaştırılmış temel özelliklere rağmen körüleme radyoterapisi alan hastalarda, sistemik terapi ile köprüleme alan hastalara göre daha üstün PFS sonuçları vardı.(Nastoupil,2020)
Önemli Noktalar
Köprüleme tedavisinin uygulanıp uygulanmayacağının ve hangi köprüleme tedavisinin seçileceğinin kararı, aşağıdaki faktörlerin dikkate alınmasını gerektirir:
23. BÖLÜM: Kemoterapiyi Köprülemek: Foliküler Lenfoma, Mantle Hücre Lenfoma ve CLL
Nico Gagelman, John Gribben ve Nicolaus Kröger
Lisocabtagene maraleucel (liso-cel) 3B sınıfı foliküler lenfomayı, özellikle agresif lenfoma belitilerinde, tedavi etmek için özel olarak onaylanan tek ürünken günümüze kadar, axi-cel indolent NHL için ilk ve tek onaylanmış CAR-T ürünüdür. ZUMA-5, iki veya daha fazla önceki sistemik terapi ile tedavi edilmiş ve bir alkilleyici ajana ve ant-CD20 terapisine maruz bırakılmış indolent NHL hastalarında (FL ve marjinal alan lenfoması da dahil olmak üzere) bir axi-cel 2. faz çalışmasıdır (Jacobson et al. 2021). Etkinlik için ölçülebilen 104 hastada, ORR %92’ydi ve CR %76’ydı. FL’li 84 hasta için, ORR %95’di (CR %80) ve MZL’li 20 hasta içinse ORR %85’di (CR %60). Daha önceki tedaviler arasındaki farklar kaydedilmemişti ve günümüze kadar, köprüleme hakkında spesifik analizler henüz sunulmamıştır. FL’deki tisa-cel üzerindeki ELARA çalışmasında 97 hasta tedavi aldı (medyan takip süresi, 10.6 ay) (Schuster et al. 2021). Önceki terapilerin medyan sayısı 4’tü (aralık, 2-13) hastaların %78’en son tedavilerine dayanıklıydı (herhangi bir ≥ 2 önceki idarelere karşı %76) ve ilk anti CD20 içeren tedaviden sonraki 2 yıl içinde %60’ı ilerledi. CR oranı %66’ydı ve ORR %86’ydı bu da köprüleme de dahil olmak üzere anahtar alt gruplar ile kıyaslanabilirdi.Ancak, kayda değer bir şekilde, indolent NHL yıllarca gerilemeden sonra nüksedebilen kronik bir hastalıktır. ZUMA-5’te rapor edilen 12 aydaki devamlı CR ve PFS oranları teşvik edici olsa da belirli tedavi dizilerinden en çok faydalanan hastaları belirlemek için daha uzun bir takip süresi gereklidir.
KTE-X19 CAR-T terapisi alan nüksetmiş veya inatçı Mantle hücreli lenfoma hastaları arasında (Wang et al. 2020), toplam 25 hasta (tüm kohortun %37’si) köprüleme terapisi alırken, ibrutinib ile 14 hasta, acalabrutinib ile 5, dexamethasone ile 12, veya methylprednisolone ile 2 hasta tedavi aldı. Köprüleme tedavisi almadan önce ve aldıktan sonra değerlendirmelerden geçen hastaların çoğunda köprüleme terapisi alımından sonra medyan tümör ağırlığında artış gösterdi. Köprüleme terapisine maruz bırakılmadan bağımsız olarak yanıt oranları benzerdi ancak devam eden yanıtlar köprüleme tedavisi almayan hastalarda daha yüksek gibi gözüktü (%67’ye karşılık %38). Kronik lenfatik lösemiye gelince, liso-cel TRANSCEND CLL 004 çalışması, standart veya yüksek riskli özellikleri, sırasıyla, Bruton kinaz inhibitörleri de dahil olmak üzere, önceki üçten veya ikiden fazla terapiyle tedavi edilmiş hastayı içerdi (Siddiqi et al. 2021). Toplam 17 hasta (%74) liso-cel üretimi sırasınds köprüleme terapisi aldı ve yanıt oranları istikrarlıydı, sırasıyla %82’si ve %45’i kapsamlı ve tam yanıtlara ulaştı. Tedavi grupları arasında güvenlik ve etkinlik benzerdi. Başka küçük bir çalışma, ibrutinib’in CD19 CAR-T terapisi ile eş zamanlı kullanımının uygunluğunu gösterdi (Gauthier et al. 2020) ancak genel popülasyon sınırlıydı ve çalışmalar hala devam etmektedir.
Önemli Noktalar
24. BÖLÜM : Kemoterapiyi Köprülemek: Çoklu Myeloma (Multiple Myeloma)
Salomon Manier, Artur Jurczyszyn ve David H. Vesole
Tüm MM Hastaları Köprüleme Terapisi Almalı Mıdır?
Aşama 2 KarMMa çalışmasında, hastaların %88’inin köprüleme terapisi almasına rağmen sadece %5 oranında yanıt alındı (Munshi et al. 2021). CARTITUDE 1 çalışmasında, hastaların %75’i köprüleme terapisi aldı ve cilta-cel aşılamasından önce hastaların %35’inde tümör ağırlığında azalma gözlendi ancak hiçbir hasta köprüleme tedavisi alırken CR’a ya da daha iyisine ulaşmadı (Madduri et al. 2019). Köprüleme terapisi hemen hemen tüm hastalara önerilmektedir. Bir istisna, leukapheresis sonrası köprüleme tedavisi almaya ihtiyacı olmayabilecek yavaş ilerleyen hastalıklı hastalar için tartışılabilir ancak bu strateji onları daha sonrasında, üretim döneminde ani ilerleme riskine maruz bırakabilir. Gelecekte, allojenik CAR-T hücreleri ile, köprüleme terapisi muhtemelen gerekli olmayacaktır çünkü hastaların dahil edilmesi ve CAR-T hücresi aşılaması arasındaki zaman fazlasıyla düşecektir.
Köprüleme Tedavilerini Kullanmak İçin Zaman Aralığı
Köprüleme terapisine leukapheresis’ten sonra hemen başlanabilir. Klinik çalışmaların çoğu hematolojik iyileşmeye izin vermek ve ilaçlar ile CAR-T hücreleri arasındaki herhangi bir etkileşimi engellemek için lymphodeplesyondan önceki iki hafta içinde hiçbir köprüleme terapisinin kullanımına izin vermemektedir (Munshi et al. 2021; Madduri et al. 2019)
Tedavi Seçimi
Birkaç çalışma sadece hastaların önceden de maruz bırakıldığı ajanlara izin vermektedir. Ancak bu strateji, hastalar daha önceki tedavilerine karşı dayanıklıysa köprüleme terapisinin etkinliğini kısıtlayabilir. Bu yüzden, köprüleme tedavileri genellikle her hasta için daha önceki tedavi yollarına, hastalık karakterlerine ve daha önceden var olan toksisitelerine bağlı olarak kişiselleştirilir. Tüm tedaviler köprüleme terapisi için dikkate alınabilir proteasome inhibitörleri, immunomodülatör ilaçlar, anti CD38 antikorları, hedefli terapiler ve konvansiyonel kemoterapiler (BCMA-hedefleyen CAR-T hücreleri durumunda antijenlerin saturasyonunu önlemek için anti-BCMA hedefli terapiler istisnadır) dahil olmak üzere. Konvansiyonel terapi kullanımı düşünülürken uzatılmış sitopenia ve enfeksiyon riski de göz önünde bulundurulmalıdır. Dahil alan radyasyon terapisi (involved field radiation therapy) köprüleme tedavisi esansında güvenle kullanılmıştır (Manjunath et al. 2020)
Önemli Noktalar
• Hemen hemen her hasta üretim döneminde hastalığın ani ilerlemesini önlemek için köprüleme tedavisi almalıdır.
• Tüm tedaviler BCMA-hedefli CAR-T hücreleri durumunda anti-BCMA terapileri istisnası ile kullanılabilir.
25. BÖLÜM: LENFODEPLETLEME ŞARTLANDIRMA REJİMLERİ
CAR-T hücre tedavisinin başarısı için lenfodepletme şartlandırma rejimleri gereklidir. Bu diyetlerin önemi CAR-T hücrelerinin çoğalmasında ve kalıcılığında son yıllarda daha da netleşti. Önerilen mekanizma tablo 25.1’de tanımlanır ve bağışıklık hücreleri ve sitokinler üzerindeki etkileri içerir, optlimal işlev için ortam yaratır ve iltihaplı CAR-T hücrelerinin genişleme zirvesini artırır.(Neelapu,2019).
Siklofosfamide fludarabine eklenmesi, CAR-T hücre tedavisinin etkinliğinin artmasında önemlidir ve şu anda en yaygın kullanılan kombinasyondur. (Turtle ve ark. 2016). Belirtilen şartlandırma rejimlerinde, 3 ardışık günde verilen 25-30 mg/m^2 fludarabin dozu nispeten tutarlıdır ancak siklofosfamit dozu gün ve yoğunluk bakımından farklılık gösterir. “daha yüksek yoğunluklu” siklofosfamit dozlama rejimi daha çok tercih ediliyor gibi görünüyor.(Hirayama,2019). Bununla birlikte en iyi lenfodepletme rejiminde bile, bazı hastalar olumlu bir sitokin formülü geliştiremiyor, bu da lenfodepletme kemoterapisinde konakçı biyolojik yanıtın önemli olduğunu düşündürtmektedir. .(Hirayama,2019). Çoğu şartlandırma rejimi ayakta tedavi esasına göre verilebilmektedir.
Anti CD-30 CAR-T hücreleri ile tedavi edilen Hodgkin lenfomada, şartlandırma rejimi olarak bendamustin kullanılmıştır, ancak bu hastalıkta, rejime fludarabinin eklenmesinin de antitümör tepkilerini arttırdığı gösterilmiştir.İnatçı tümörlerde daha da yoğun bir rejimin gerekli olup olmadığı henüz bilinmiyor.
|
Şartlandırma Rejiminin Etkileri |
|
|
Lenfodeplesyon |
Toplam doğal katil, B ve T hücrelerinin sayısının düşmesi |
|
Daha az sayıda anti CAR-T hücre immün cevabı |
Anti-transgen immün reaksiyonların azalması |
|
İmmün supresör hücrelerin yok edilmesi |
Tregler ve MDSC’ler |
|
Tümör supresif etkilerin geçişi/ hafiflemesi |
IDO ekspresyonunun düşüşü, co-stimülatör moleküllerin seviyesinin yükselmesi |
|
Hemostatik sitokin havuzunun ortadan kalkması |
MCP-1 ekspresyon, IL-2, IL-7, IL-15 seviyelerinin yükselmesi |
|
CAR-T hücrelerinin genişleme, fonksiyon, inatçılığının artması |
Daha iyi ve uzun ömürlü tümör cevapları |
Tregler: Düzenleyici T hücreler
MDSC: Myeloid türevli supresör hücreler
IDO: Indoleamine deoksigenaz
MCP-1: Monosit kromoatraktan protein-1
Şartlandırma rejiminin zamanlaması, genellikle planlanan infüzyondan 1 hafta önce ve infüze edilmiş hücrelerin kemoterapinin negatif etkilerinden korunmak için en az 2 gün dinlenmesi ile olur. Eğer şartlandırma rejiminin başlamasından sonra hasta CAR-T hücreleri üretemezse birçok protokol yeni bir rejime başlamadan önce 2-4 hafta bekleme zamanına izin veriyor. Diğer protokollerde ise eğer mutlak lenfosit sayımı 20 hücre/mikrolitre’nin altında ise rejim verilmiyor.
Şartlandırma rejiminin negatif etkileri pansitopeni ve uzun süreli immün baskılanmasını içerir ve bunlar CAR-T hücre tedavisinden sonra görülen enfeksiyon riskini artırır. Ek olarak fludarabine; ateşi, nörotoksisit siklofosfamit hemorajik sistikleri ve perikardisitleri uyarabilir ve her iki ilaç da ikincil malignitelerin riskini artırabilir.
Önemli Noktalar
26. BÖLÜM: SİTOKİN SALINIM SENDROMU(CRS) YÖNETİMİ VE HLH
Francis Ayuk Ayuketang ve Ulrich Jager
SİTOKİN SALINIM SENDROMU(CRS)
Tanı ve Oluşumu
Sitokin salınım sendromu(CRS), özellikle immünoterapiden sonra immün reaksyonlarda yer alan immün hücrelerden sitokinlerin hızlı ve hafif salınımından kaynaklanır. CAR-T hücre tedavisinden sonra CRS’nin sıklığı ve şiddet ürünler arasında değişiklik gösterir.( herhangi bir derece: %37,93 , G3/4: % 1-23) ( Neelapu, 2017; Schuster,2019; Abramson,2020)
Teşhis
Klinik Belirtiler, Laboratuvar Teşhisi, Ayırıcı Teşhis ve Tahmin Edici Faktörler
CRS genellikle halsizlik, baş ağrısı, artralji, anoreksi, titreme ve yorgunluk gibi genel semptomlardan önce veya bunlara eşlik eden ateş ile kendini gösterir ve hızlı bir şekilde hipoksi, hızlı solunum, taşikardi, hipertansiyon, aritmiye ilerleyebilir ve bu da şok kardiyorespiratuvar organ fonksiyon bozukluğuna ve organ yetmezliği ile sonuçlanır.
CRS tanısı, laboratuar teşhisleriyle belirlenemese veya ekarte edilemese de organ fonksiyon bozukluğunu izlemek için kullanılabilir. CRS semptomları ve laboratuvar bulguları enfeksiyonu yakından taklit eder; bu nedenle, bulaşıcı çalışma ve tedavi birincil öneme sahiptir. Diğer ilgili ayırıcı tanı, tümör lizisini ve altta yatan malignitenin ilerlemesini içerir.
Bireysel bir hastada CRS tahmini şu an mümkün değildir. Bununla birlikte, yüksek tümör yükü CAR-T hücre dozu gibi bazı faktörlerin daha yüksek CRS riski ile ilişkili olduğu görülmektedir.
Yönetimi
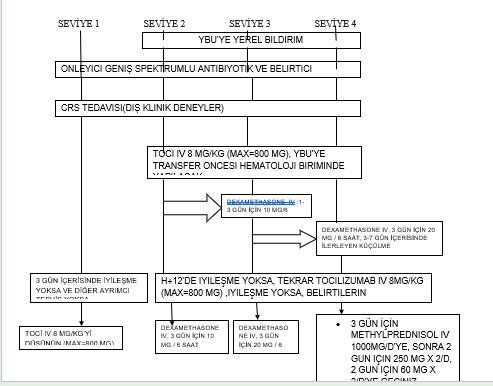
CAR-T hücrelerini alan hastalarda kardiyovasküler fonksiyon ve ateş sürekli olarak veya düzenli aralıklarla izlenmelidir. CRS’nin ilk belirtisi genellikle ateştir. Hafif CRS( G1) konservatif olarak idare edilebilir. Tüm yüksek dereceler, yoğun izleme ve müdahale gerektirir. Tocilizumabın erken kullanımı ve bazı durumlarda stereoitler önerilir. (Tablo 26.1) ( Yakoub – Agha 2020)
TABLO 26.1 CRS Planlaması ( Yakoub- Agha ve ark. 2020’den uyarlandı)
TABLO 26.1 CRS Planlaması ( Yakoub- Agha ve ark. 2020’den uyarlandı)
|
CRS PARAMETRESİ |
GRAD 1 |
GRAD 2 |
GRAD 3 |
GRAD 4 |
|
ATEŞ |
Ateş>=38( herhangi bir nedene bağlanamaz). KRS'si olan ve daha sonra tosilizumab veya steroidler gibi ateş düşürücü ve anti sitokin tedavisi alan hastalarda, sonraki KRS şiddetini derecelendirmek için artık ateş gerekli değildir. Bu durumda, CRS derecelendirmesi, hipotansiyon ve/veya hipoksi ile yürütülür. |
|
|
|
|
HİPOTANSİYON |
YOK |
VAZOPRESÖR GEREKTİRMEZ |
VAZOPRESSİNLİ VEYA VAZOPRESSİZ /VAZOPRESÖR GEREKTİRME |
BİRDEN FAZLA VAZOPRESÖR GEREKTİRİR.(VAZOPRESSİN HARİÇ) |
|
HİPOKSİ |
YOK |
DÜŞÜK AKIŞLI OKSİJEN GEREKTİRİR ( <= 6 L/DAKİKADA VERİLİR) |
YÜKSEK AKIŞLI OKSİJEN GEREKTİRİR ( <= 6 L/DAKİKADA VERİLİR) |
POZİTİF BASINÇ GEREKTİRİR( ÖRNEĞİN CPAP, BİPAP, ENTÜBASYON VE MEKANİK VENTİLASYON) |
İzleme: CRS 1'li hastalar normal koğuşta veya Orta Bakım koğuşunda ,G2'den başlayarak, izlenebilir ve bir yoğun bakım ünitesine kabul düşünülmelidir.
Destekleyici tedavi sıvılar ve ateş düşürücülerden oluşur. Vazopresörlerin kullanımı otomatik olarak daha yüksek dereceli CRS'yi işaretler.
Anti-Sitokinler
Tocilizumab, CRS tedavisi için EMA ve FDA onaylıdır. Profilaktik. önleyici veya riske göre uyarlanmış kullanım, antitümör etkinliğini azaltmadan şiddetli CRS riskini azaltabilir.
(C_Locke et al. 2017; Caimi et al. 2020: Gardner et al. 2019; Kadauke et al. 2021).
Siltuximab ve anakinra kullanımına ilişkin klinik çalışma verileri hala eksiktir.
Steroidler
İlk Klinik çalışmaların aksine, kısa steroid kürleri yok gibi görünüyor. CAR-T hücre genişlemesi ve hayatta kalma veya klinik sonuç üzerinde zararlı etkiler.
Antibiyotikler
CRS enfeksiyondan kesin olarak ayırt edilemediği için çoğu merkez nötropenik ateş vakalarında antibiyotik tedavisi uygular. Ancak ilk birkaç hafta büyüme faktörlerinin kullanımı kısıtlanmalıdır. GM-CSF'den kaçınılmalıdır.
sHLH/MAS
Sekonder veya reaktif hemofagesitik Lenfohistiyositoz (sHLH), hematolojik maligniteler, enfeksiyon ve romatizmal veya otoimmün hastalık bağlamında ortaya çıkan ve hiperaktif makrofajlar ve lenfositler, hemofagositoz ve çoklu organ hasarı ile karakterize hayatı tehdit eden bir hiperinflamasyon sendromudur. (Carter et al. 2019; Neelapu et al. 2018; Sandler et al. 2020). Önerilen tanı kriterleri Tablo 26.2'de özetlenmiştir. sHLH'nin yönetimi, genellikle şiddetli CRS'dekine benzer algoritmaları takip eder. Dirençli hastalarda tedavi Mehta et al.(2020), anakinra için kilit bir role sahip.
|
CAR-T hücre aracılı sHLA/MAS için tanı kriterleri (Neelapu et al. 2018) |
Yetişkin HScore (Fardet et al. 2014) Flespektif puanlar parantez içindedir Bir muhtemel sonuç üretir: skor >169dan büyükken %93 hassas ve HLH için %88 özeldir |
|
klinik |
klinik |
|
Derece > 3 pulmoner ödem |
Ateş: <38,4 (0); 38,4—-39,4 (33): >39,4 (49) |
|
|
Hepatomealy: Hiçbiri (0): hepatomegali veya splenomegali (23); ikisi de (38) |
|
|
İmmünosupresyon: Hayır (0): evet (18)
|
|
laboratuvar |
laboratuvar |
|
CRS sırasında 10.000ng/ml'lik pik ferritin ve aşağıdakilerden herhangi 2'sini takiben |
Ferritin, ng/mL: <2000 (0); 2000-6000 (35); >6000(50) |
|
Serum billrubin, aspartatta aminotransferaz veya alanin aminktansetaz seviyelerinde Derece >3 artış
|
Sitopeni >2 soy: Bir soy (0), iki soy (24) veya üç soy (34) |
|
Oligüri veya serum kreatinin düzeylerinde Derece >3 artış” |
Hipertrigliseridemi,mmol: <1.5 (0); 1-5-4 (44): >4 (64) |
|
Kemik iliğinde hemofagooytoz varlığı veya hücrenin histopatolojik değerlendirmesine dayalı organlar morfoloji ve/veya CD68 İmmünhistokimya |
Hemofagosit: Hayır (0), evet (35)
Karaciğer fonksiyon testleri, IU/L: AST<30 (0); >30 (19) |
|
* Ortak Terminoloji Kriterlerine göre Zıt Olaylar (CTCAE) Sürüm 4.0, |
Hipofibrinojenemi, g/L: >2,5 (0) <2,5 (30) |
Önemli Noktalar
27.BÖLÜM:
CAR-T hücre tedavisi ile ilişkili yaygın ve zorlu bir yan etki, hastaların %20-60'ında görülen ve %12-30'unda şiddetli (> derece 3) semptomlar bulunan immün hücre ile ilişkili nörotoksisite sendromudur (ICANS). Sendromu yönlendiren altta yatan mekanizma tam olarak anlaşılamamıştır, ancak makrofajlar ve monositler tarafından salgılanan inflamatuar sitokinlerin salınmasına, vasküler geçirgenliği ve endotel aktivasyonunu artırdığına ve kan-beyin bariyerinin bozulmasına yol açtığına dair kanıtlar vardır. ICANS'ın doğrudan olduğu düşünülmemektedir. CAR-T hücrelerinin kendileri aracılık eder.
ICANS için risk faktörleri arasında yüksek hastalık yükü, ileri yaş ve spesifik CAR-T ürünü yer alır.
ICANS başlangıcı (ortalama olarak) CAR-T hücre infüzyonundan yaklaşık 5 gün sonra meydana gelir ve bazen sitokin salınım sendromu (CRS) ile eşzamanlı veya kısa bir süre sonra ortaya çıkar, Bununla birlikte, hastaların yaklaşık %10'unda ICANS, CAR-T hücre infüzyonundan 3 hafta sonra ortaya çıkar.
ICANS belirtileri değişkendir ve başlangıçta belirsiz olabilir. Hastalar hafif titreme ve kafa karışıklığı yaşarlar ve bu daha sonra ajitasyona, nöbetlere ve beyin ödemine kadar gidebilir. ICANS'ın öne çıkan ve erken bir özelliği, konuşmada tereddüt etme ve el yazısında bozulma olup, bu hem ifade hem de ifade ile afaziye ilerleyebilir. ve alıcı bileşenler, bu sayede hasta uyanık ama sessizdir. ICANS'ın en yıkıcı sonucu, status epileptikus, ölümcül beyin ödemi ve bazen de intraserebral kanamanın ortaya çıkmasıdır.
ICANS klinik bir tanıdır—beyin MRG ve BOS değerlendirmesi nadiren yardımcı olur ancak alternatif tanıları dışlamak için kullanılabilir, örn. CNS enfeksiyonu.
Tablo 27.1 İmmün Efektör Hücre Ensefalopatisi (ICE) Skoru
İmmün Efektör Hücre Ensefalopatisi (ICE) Skoru
Oryantasyon: Yıl, ay, şehir, hastaneye oryantasyon: 4 puan
Adlandırma: 3 nesneyi adlandırabilme (örnek: noktadan saat, kalem, düğme): 3 puan
Aşağıdaki komutlar: Basit komutları takip etme yeteneği (örnek: “gözlerini kapat ve dilini çıkar”): 1 puan
+ Yazma: Standart bir cümle yazabilme becerisi (örnek: “ulusal kuşumuz kel kartaldır”): 1 puan
+ Dikkat: 100'den 10'a kadar geriye doğru sayabilme: 1 puan
EEG Kaydı normal olabilir, ancak konvülsif olmayan status epileptikus dahil olmak üzere değişken anormalliklerin bir modelini de gösterebilir.
Çoğu vaka, genellikle destekleyici bakım ve kortikosteroid tedavisi ile erken müdahale ile kendiliğinden düzelir.
Yön, dikkat, yazı ve dili değerlendiren 10 noktalı İmmün Etkileyici Hücre Ensefalopatisi (ICE) skoru (Tablo 27.1) kullanılarak bilişteki ince değişiklikleri değerlendirmek için tüm hastalar ICANS için proaktif olarak günde iki kez izlenmelidir. Bu puan daha sonra bir ICANS derecesi elde etmek için nöbet aktivitesi, bilinç düzeyindeki değişiklik, motor bulgular ve intraserebral basınç/beyin ödemindeki yükselmeyi içeren nörolojik fonksiyonun genel bir değerlendirmesine entegre edilir. ICE puanı ne kadar yüksek olursa, ICANS derecesi o kadar düşük olur. ICE skoru 2'nin altında olan veya nöbet geçiren herhangi bir hasta şiddetli (derece 3 veya 4) olarak sınıflandırılır ve yoğun bakıma transfer edilmelidir. Derece 3ten daha büyük ICANS riski ile ilişkili faktörler arasında daha yüksek hastalık yükü, düşük trombosit sayısı ve erken ve şiddetli CRS gelişimi yer alır.
ICANS'ın yönetimi, puanın ciddiyetine ve CRS'nin uyumuna dayanır. Yönetim derece 1 ICANS için destekleyicidir ve derece >2 ICANS için hızlı sivrilen deksametazon verilir. Önerilen dozlar, 2-3 dereceler için her 6 saatte bir 10-20 nag intravenöz deksametazon ve semptomlar düzelene kadar derece 4 için en az 3 gün boyunca 1 g IV metilprednizolon içerir. Nöbetler leveti-rasetam ile ve status epileptikus benzodiazepinlerle tedavi edilir. Profilaktik anti-epileptik ilaçların kullanılmasını önermiyoruz.
ICANS yönetimine yönelik diğer deneysel yaklaşımlar, CAR'ın kendisinin gücünü kontrol etmeye yönlendirilmiştir. Birkaç CAR yapısı, şiddetli toksisite durumunda CAR'ı kapatmak veya düşürmek için tasarlanmış mekanizmalar dahil edilerek "intihar anahtarları" veya "ayarlanabilir ARAÇ'lar" olarak tasarlanmıştır. Ciddi yanıt vermeyen vakalarda, anakinra (IL-1 reseptör antagonisti) veya CAR-T hücrelerini öldürmek için kemoterapi kullanılmıştır. Bununla birlikte, çoğu vaka çözülür ve artık nörobilişsel hasarla sonuçlanmaz (Tablo 27.2 ve 27.3).
Önemli noktalar
•ICANS, genellikle sitokin salınım sendromundan sonra, bir haftalık infüzyonla ortaya çıkan, GAR-T hücre tedavisinin yaygın ve genellikle geri dönüşümlü bir toksisitesidir.
•ICANS klinik bir tanıdır - yaygın erken belirtiler sözcük bulma güçlükleri, kafa karışıklığı ve ince motor becerilerin bozulmasını içerir. Araştırmalar, CNS enfeksiyonu gibi alternatif bir teşhisi dışlamak dışında nadiren yardımcı olur.
•Şiddetli ICANS nöbet, koma ve beyin ödeminden oluşur ve ITU bakımı gerektirir.
• ICANS'ın yönetimi büyük ölçüde destekleyicidir ve önem derecesine bağlıdır. Kortikosteroid, Derece I ICANS dışındaki herkes için bakımın temel dayanağıdır ve hızlı bir şekilde azaltılarak yüksek dozlarda reçete edilmelidir.
•Prognoz iyidir ve hastaların çoğu uzun süreli komplikasyon olmadan tamamen iyileşir.
TABLO: Amerikan organ nakli ve hücresel tedavi derneği yetişkinler için ICANS fikir birliği ( tabloyu önce sol sonra sağ sütün olacak şekilde inceleyiniz.)
|
Genel ICANS kademe
|
Nöbet
|
|
Kademe1 |
N/A |
|
Kademe2 |
N/A |
|
Kademe3 |
EEG'de müdahale ile düzelen, hızla düzelen veya konvülsif olmayan nöbetler olan fokal veya jeneralize herhangi bir klinik nöbet |
|
Kademe4 |
Yaşamı tehdit eden uzun süreli nöbet veya arada başlangıca dönmeden tekrarlayan klinik veya elektriksel nöbetler |
|
ICE skoru
|
Motor bulguları
|
|
7-9 |
N/A |
|
3-6 |
N/A |
|
0-2 |
N/A |
|
0 (hasta uyandırılamaz ve ICE değerlendirmesini yapamıyor) |
Fokal motor zayıflığı |
|
Depresif seviye bilinç
|
Yüksek ICP/serebral ödem |
|
Kendiliğinden uyanmak |
N/A |
|
Ses ile uyanmak |
N/A |
|
Dokunsal uyarıcı ile uyanmak |
Nörogörüntülemede fokal lokal ödem |
|
Hasta uyandırılamaz veya uyandırmak için kuvvetli veya tekrarlayan dokunsal uyaranlara ihtiyaç duyar |
Nörogörüntülemede serebral veya dekortikal postürde yaygın serebral ödem, 6. Sinir paralizisi, papilödem veya Cushing triyadı |
ICANS derecesi en ciddi olaya göre belirlenir.(bilinç düzeyi , nöbet, motor bulgular, ........ ICP/serebral ödem) başka bir nedene bağlanamaz; örneğin, ICE skoru 3 olan ve nöbet geçiren bir hasta, 3.derece ICANS olarak sınıflandırılır.N/A, geçerli olmadığını belirtir.
ICE skoru 0 olan bir hasta, global afazi ile uyanıksa derece 3 ICANS'ye sahip olarak sınıflandırılabilir, ancak ICE skoru 0 olan bir hasta uyandırılamıyorsa, derece 4 ICANS'a sahip olarak sınıflandırılabilir.
Depresif bilinç düzeyi başka bir nedenle (örneğin, yatıştırıcı ilaç yok) nitelenebilir olmalıdır.
İmmün efektör tedavilerle ilişkili titreme ve miyoklonus, CTCAE v5.0'a göre derecelendirilebilir, ancak bunlar ICANS derecelendirmesini etkilemez.
Ödemli veya ödemsiz intrakraniyal kanama, bir nörotoksisite özelliği olarak kabul edilmez ve ICANS derecelendirmesinden hariç tutulur. CTCAE v5.0'a göre derecelendirilebilir.
TABLO: ICANS yönetimine yaklaşım
|
ICANS kademesi |
Yönetim
|
|
Kademe 1 |
Levetirasetam nöbet profilaksisini düşünün (750 mg BD) Merkezi sinir sistemi depresyonuna neden olan ilaçlardan kaçının Nöroloji uzmanı konsültasyonu isteyin Destekleyici bakım Papilloödemi değerlendirmek için fundoskopik muayene Kontrastlı beyin MRG'si (beyin MRG'si mümkün değilse beyin BT'si) Mümkünse, kültür ve duyarlılık, sitoloji, biyokimya ve viroloji için numuneler göndererek, mümkünse açma basıncını ölçerek tanısal lomber ponksiyonu düşünün. Hastanın fokal periferik nörolojik defisitleri varsa omurga MRG'yi düşünün Elektroensefalogramı (EEG) düşünün Tocilizumab 8mg/kg'ı düşünün, ancak yalnızca eşzamanlı KRS varsa ICE skorunu ve ICANS derecelendirmesini kullanarak günde iki kez nörobilişsel değerlendirme |
|
Kademe 2
|
1. sınıfa göre araştırmalar ve destekleyici bakım Hızlı sütten kesme ile yüksek dozda deksametazon düşünün Hastayı yoğun bakım ünitesine (YBÜ) transfer etmeyi düşünün |
|
Kademe 3 |
1. sınıfa göre araştırmalar ve destekleyici bakım Derece 1'e iyileşene kadar her 6 saatte bir 10-20 mg IV deksametazon veya metlyprednizolon eşdeğeri uygulayın ve ardından azalan Gerektiğinde lorazepam 0.5 mg IV veya diğer benzodiazepinler ile nöbetlerin yönetimi, ardından gerektiğinde levetirasetam veya diğer antikonvülzanlarla yükleme Fundoskopi, beyin omurilik sıvısı (BOS) açma basıncı > 20 mmHg olan evre 1 veya 2 papilloödem ortaya çıkarırsa, nörologdan acil tavsiye alın Hastanın kalıcı derecesi >= 3 ICANS varsa, her 2-3 günde bir nörogörüntülemeyi (CT veya MRI) tekrarlamayı düşünün. |
|
Kademe 4 |
1. sınıfa göre araştırmalar ve destekleyici bakım Hastayı yoğun bakım ünitesine (YBÜ) transfer edin; hava yolu koruması için mekanik ventilasyonu düşünün 3. sınıfa göre nöbet yönetimi Konvülsif status epileptikus için nörologdan acil tavsiye alın 3 gün boyunca 1000 mg/gün metilprednizolon uygulayın, ardından 2 gün boyunca 12 saatte bir 250 mg, ardından 2 gün boyunca 12 saatte bir 125 mg, ardından 2 gün boyunca 12 saatte bir 60 mg olarak azaltın. Artmış kafa içi basıncının yönetimi için, asetazolamid 1000 mg IV'ü ve ardından her 12 saatte bir 250-100 mg IV'ü düşünün; yatağın başının kaldırılması; hiperventilasyon; ve mannitol ile hiperosmolar tedavi |
28. BÖLÜM: Hipogamaglobulinemi ve B hücre aplazisinin yönetimi
Max Topp ve Toblas Feuchtinger
CD19 veya CD22 gibi B-soy yüzey antijenlerini hedefleyen CAR-T hücre tedavilerinin geliştirilmesi ve düzenleyici onayı (Maude ve ark. 2018), kanser immünoterapisinde önemli bir kilometre taşını temsil eder. Bu tedavi, malign ve normal B hücrelerinin tükenmesine neden olur ve hipogamaglobulinemi ile ilişkilidir.Bu hedefe yönelik, tümör dışı toksisiteler, enfeksiyon riskinin artmasına neden olabilir. CAR-T hücre tedavisi alan hastaların dikkatli uzun vadeli takip değerlendirmesi önemlidir. Bu hedefe yönelik, tümör dışı etkilerin yönetimi, eğer hasta tedaviyi takiben yerel sağlayıcılara dönerse, tedavi ve sevk eden merkezler arasında iyi koordine edilmelidir. Bu toksisite yönetiminin amaçları:
B hücre aplazisinin izlenmesi, tedavinin iki yönü hakkında bilgi sağlar.
İlk olarak, B hücre aplazisi, işlevsel CAR kalıcılığının bir işaretidir ve genellikle CAR-T hücrelerinin kendilerinin doğrudan saptanmasından daha uzun kalıcılık gösterir. B-hücresi aplazisinin izlenmesi, CAR-T hücre yetmezliği vakalarında malign hastalığın (örn., görüntüleme, MRD) ve müteakip allojenik HSCT'nin izlenme aralığına ilişkin kararlara rehberlik edebilir. bu nedenle, B hücre aplazisi remisyonla birlikte izlenmelidir.
Bu nedenle B hücre aplazisi, gerileme düzeyi ve CAR devamlılığı ile birlikte izlenmelidir. İkinci olarak B hücre aplazisi, IgG takviyesinin yavaş yavaş azaltılması veya devam ettirilmesi için yardımcı bir parametredir. B hücre aplazisinin izlenmesine ilişkin tavsiyenin kanıt düzeyi uzman görüşüne dayanmaktadır ve farklı hasta yaş gruplarında çok az değişiklik göstermektedir.
Çünkü anti-CD19 ve anti-CD22 CAR-T hücreleri, B sınıfı öncüllere saldırır ve CAR-T hücre tedavisinden sonra hastalarda sıklıkla uzun süreli hipogamaglobulinemi veya agamaglobulinemi görülür. Pediatrik merkezlerde, CAR-T hücre tedavisini takiben immünoglobulin replasmanı yapılması genel bir yaklaşım haline gelmiştir (Maude ve arkadaşları, 2014). Buna karşın, CAR-T hücre tedavisinden sonra plazma hücre aplazisi ve hipogamaglobulinemisi olan yetişkinlerde sistematik IgG takviyesi konusunda bir fikir birliği bulunmamaktadır. Kalıcı B hücre aplazisi, sinopulmoner enfeksiyonlarla özellikle de kapsüllü bakterilerle ilişkili olduğundan (Fishman ve arkadaşları, 2019) hipogamaglobulinemi ile birlikte tekrarlayan veya kronik enfeksiyonları özellikle de pnömonisi olan tüm hastalarda intravenöz immünoglobulin replasmanı yapılır. Allogenik HSCT artı CAR-T hücre tedavisinden sonra hastalar enfeksiyonla ilişkili morbiditede artışla karşı karşıya kalırlar ve bu nedenle yoğun (belki de ömür boyu) IgG takviyesine ihtiyaç duyabilirler.
IgG takviyesi ömür boyu sürebilir veya en azından fonksiyonel B hücreleri ve plazma hücreleri iyileşene kadar devam edebilir. Ancak CAR-T hücre tedavisi alıcılarında proflaktlik IgG replasmanının etkinliğine ilişkin veriler sınırlıdır (Hill ve arkadaşları, 2019) ve mevcut uzman tavsiyeleri (Mahadeo ve arkadaşları, 2019; Yakoup-Agha ve arkadaşları, 2020) birincil immün yetmezliği olan bireyler için verilerden hareketle ekstrapole edilmiştir (Perez ve arkadaşları, 2017; Picard ve arkadaşları 2018). Bruton agamaglobulinemisi olan hastaların uzun süreli takip sonuçları, organ hasarını önlemek ve uzun süreli yaşam kalitesini korumak için immünoglobulin seviyelerinin ve akut, kronik ve özellikle de sessiz enfeksiyonların yakından izlenmesi için bir gerekçe sunmaktadır. Bireyselleştirilmiş rejimler, yetişkinlerde serum immünoglobulin seviyelerini 400 μg/L'nin üzerinde tutmayı ve çocuklar için de yaşlara göre uyarlanmış normal aralıkları korumayı amaçlamaktadır. İntravenöz immünoglobulinler (IVIG'ler) genellikle her 3-6 haftada bir veya haftada bir deri altına (SCIG'ler) verilir. IVIG dozları 0,4 g/kg vücut ağırlığı ve SCIG dozları 0,1-0,15 g/kg vücut ağırlığında belirtilmiştir. Doz aralıkları enfeksiyonlara ve serum IgG seviyelerine göre belirlenir. Dengeli duruma ulaştıktan sonra, serum IgG seviyeleri en az 3 ayda bir kontrol edilmelidir.
B-hücre aplazisi ve hipogamaglobülinemi tedavisinde kanıta dayalı yaklaşımlar oluşturmak için çalışmalara ihtiyaç vardır. Bu bağlamda profilaktik immünoglobulin uygulaması ve stratejileri hastaya ve CAR-T hücre ürünü özelliklerine göre farklılık gösterebilir.
Önemli Noktalar:
29. BÖLÜM : MİYELOTOKSİSİTE (APLASİ) YÖNETİMİ VE ENFEKSİYON KOMPLİKASYONLARI
Marion Subklewe and Reuben Benjamin
Hematolojik toksisite CAR-T hücre terapisinden sonra en yaygın olumsuz olaydır ve gerçek dünyada 1 yıllık kümülatif insidansı %58'dir. (CTCAE derece ≥ 3) (Wudhikarn ve diğerleri, Blood Advances 2020) Bifazik temporal seyirle karakterize edilir ve çoğunlukla uzatılmıştır. (Fried ve diğerleri, Kemikiliği Transplantasyonu 2019, Rejeski ve diğerleri, Blood ve diğerleri 2021a, b, Resim 29.1) Axi- Cel terapili hastaların raporunda, CAR-T hücre tedavisini takip eden 30 günde sadece %30'u nötrofil sayısını > 1x10⁹/L ve %50'si platelet sayısını > 50x10⁹/L gösterdi. (Jain ve diğerleri, Kan ilerlemeleri 2020) Devam eden CR ve MDS yokluğu olan hastaların uzun vadeli bir takip çalışmasında, hastaların %16'sı CAR-T hücre tedavisinden sonra 22 aya kadar uzun süreli önemli sitopeniler yaşadı. (Cordeiro ve diğerleri, Biol Kemikiliği Transplantasyonu 2020.) Bu bulgular sitopeninin lenfotüketimden ve akut CRS'nin çözülmesinden çok sonra ortaya çıkabileceğini vurgulamaktadır.Ciddi CRS/ICANS, lenfotüketici kemoterapinin başlatılmasından önce sitopeni ve önceki allojenik kök hücre nakli risk faktörleri arasındadır. (Jain ve diğerlei, Kan ilerlemeleri 2020, Fried ve diğerleri, BMT, 2019). Daha da önemlisi, sitopeni, hastaları nüksetmeyen mortalitenin en sık nedeni olan ciddi enfeksiyöz komplikasyonlara yatkın hale getirir. (Nastoupil ve diğerleri, JCO 2020). CAR-T hücre terapisinden sonra erken sitopenileri yönetmek için büyüme faktörlerinin kullanımın tartışmalıdır.Sitokin profilleri ve fare ksenograft modelleri,CRS ve nöroinflamasyonun patogenezinde GM-CSF'yi içermektedir. (Sterner ve diğerleri, Kan 2019) Buna göre, mevcut öneriler, GM-CSF kullanımını ve G-CSF'yi yalnızca CRS ve/veya ICANS'ın çözümünden sonra bailatmayı teşvik etmemektedir. (Yakoub-Agha ve diğerleri, Hematoloji 2020) Fakat, Galli ve diğerlerinin bir raporunda, profilaktik G-CSF, CAR-T hücre infüzyonundan sonra 5.günde 4.derece nötropenisi olan 42 hastada,CRS veya ICANS riskinde artış ve hastalık sonuçları üzerinde olumsuz bir etkisi olmaksızın güvenle kullanıldı. (Galli ve diğerleri, Kemikiliği transplantasyonu 2020)
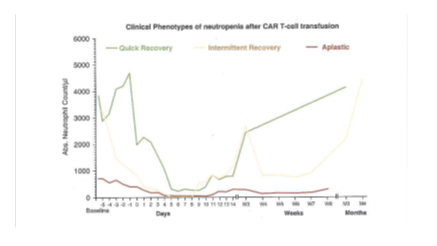
Resim.29.1 Nöropeninin Klinik Fenotipleri (Rejeski ve diğerlerinden uyarlandı, Kan 2021a, b)
Uzamış nötropeni için yüksek risk altındaki ve erken G-CSF başlangıcından fayda sağlayacak artmış enfeksiyon riski olan hastaları
belirlemek için daha ileri çalışmalara ihtiyaç vardır. G-CSF'ye yanıt vermeyen uzun süreli sitopenisi olan hastalar için tanısal çalışma;
hematinik eksiklik, viral enfeksiyonlar (örn. CMV, EMV, Hepatit B/C, Parvovirüs B19), eşlik eden miyelosupresif ilaç (örn. cotrimoxazole),
ikincil hemofagositik lenfohistiyositoz ve kemik iliğinde hastalık varlığı için taramayı içermelidir.G-CSF'ye yanıt
vermeyen şiddetli kemik iliği aplazisi durumunda, mümkün olduğunda otolog veya allojenik kök hücre kurtarma düşünülebilir.(rejeski
ve diğerleri, BMC ID 2021a, b, Godel ve diğerleri, Haemasphen 2021) Diğer opsiyonlar anti inflamatuvar terapi (örn. deksametazon,
anti IL-6 bloke edici terapi) ve trombopoietin reseptör agonistlerini (örn. eltrombopag) içerir. (Resim 29.2).
Enfeksiyonlar, uzun süreli nötropeni, uzun süreli CD4 T hücresi lenfopeni veya B-hücre aplazisinin bir sonucu olarak CAR-T
tedavisinin bir başka önemli komplikasyonudur. (Hi and Seo ve diğerleri, Kan 2020a, b) Yüksek CRS derecesi ve steroid, tocilzumab
ve anakinra gibi immünosupresant ajanların kullanımı enfeksiyonlarla ilgili diğer risk faktörleri arasındadır. Enfeksiyonların çoğu, ilk
28 gün içinde erken ortaya çıkar ve bakteriyel enfeksiyonlar en yaygın olanıdır, bunu viral ve mantar enfeksiyonları izler.Geç
enfeksiyonlar, özellikle solunum yolu virüsleri, CAR-T tedavisinden 90 gün sonra da görülür.(Cordeiro ve diğerleri, BBMT 2020)
CAR-T ile tedavi edilen hastaların %1-15'inde hem maya hem de küf içeren istilacı mantar enfeksiyonları bildirilmiştir.
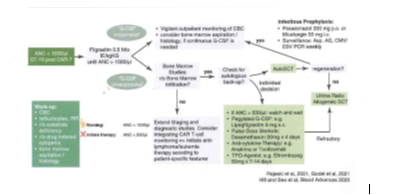
Resim 29.2 CD19 CAR-T hücresi ile ilişkili miyelotoksisite için tedavi algoritması
CAR-T hücre tedavisi sonrası enfeksiyon riskini azaltmak için antiviral, antifungal ve anti-pneumocystis (PCP) profilaksisi
kullanılması önerilir; ancak optimal profilaksi seçimi ve süresi konusunda bir fikir birliği yoktur. Hastalara tipik olarak asiklovir veya
valasiklovir, maya veya küfe karşı aktif antifungal profilaksi ve PCP'yi önlemek icin ko-trimoksazol verilir. İnfüzyon öncesi nötropeni,
6 ay içinde küf enfeksiyonu öyküsü, önceden allo-SCT veya altta yatan akut lösemi teşhisine dayanan küf enfeksiyonlar için "yüksek
risk" olarak kabul edilen hastalar ve ayrıca infüzyon sonrası derece ≥ 3 CRS/ICANS olanlar veya steroidler, diger immünosupresanlarla
uzun süreli tedavi, küf-aktif profilaksi önerilmelidir. Yüksek risk faktörlerinin yokluğunda, küfler icin önleyici izleme tavsiye edilerek
maya aktif profilaksi yeterli olabilir (Garner ve diğerleri, J Fungi 2021). Antifungal profilaksi genellikle nötrofil sayısı düzelene ve
immünosupresanların kesilmesine kadar sürdürülür. PCP profilaksisi tipik olarak 6 ay boyunca veya CD4 T hücre sayısı >200 hücre/pl
olana kadar verilir. Kalıcı şiddetli hipogamaglobulinemi ve tekrarlayan enfeksiyon öyküsü olduğunda aylık intravenöz
immünoglobulinler düşünülebilir.CAR-T tedavisi sonrası şüpheli/doğrulanmış enfeksiyonların tedavisi Kurumsal yönergeleri takip
etmelidir ve genellikle kök hücre transplantasyonundan sonraki enfeksiyonların yönetimine benzer.CD19- veya BCMA-hedefli CAR-T
hücrelerinin uygulanmasını takiben aşılamanın etkinliği bilinmemektedir, ancak hastaların CAR-T tedavisinden 6 ay sonra aşılama için
düşünülmesi ve aşı sonrası antikor titrelerinin rehberliğinde yapılması gerekir. (Hill ve diğerleri, Kan 2020a, b) CAR-T hücre
infüzyonunu takiben enfeksiyöz komplikasyonları önlemeye ve yönetmeye yönelik etkili stratejiler, bu umut verici tedavinin
sonuçlarını iyileştirmede çok önemlidir.
Önemli Noktalar:
Hematolojik toksisite, CD19'a özgü CAR-T hücre tedavisinden sonra en sık görülen advers olaydır ve hastaları ◦ şiddetli enfeksiyonal
komplikasyona yatkın hale getirebilir.
antilenfoma aktivitesinin korunmasında güvenlidir.Kanıt düzeyi III-B.
hipogamaglobulinemi) ve enfeksiyonlar, nüks olmayan mortaliteye önemli ölçüde katkıda bulunur.
30. BÖLÜM: DİĞER TOKSİSİTELERİN YÖNETİMİ
Hermann Einsele and Ibrahim Yakoub-Agha
Sekonder hemofagositik lenfohistiyositoz (sHLH) veya makrofaj aktivasyon sendromu (MAS), COVID-19 enfeksiyonu,
malignite veya otoimmün hastalıklar gibi ciddi enfeksiyonları olan hastalarda ortaya çıkabılen hayatı tehdit eden bir hiperinflamatuar
sendromdur. Aynı zamanda, altta yatan tetik mekanizmasından veya yüksek mortalite ile ilişkili altta yatan bozukluklardan bağımsız
olarak, allojenik hematopoietik hücre transplantasyonunun (allo-HCT) nadir bir komplikasyonudur.CAR-T hücre tedavisini takiben
sHH/MAS oluşumuna ilişkin artan raporlar vardır, ancak bunun sitokin salınım sendromundan (CRS) ayrımı genellikle zordur (Sandler
ve ark. 2020). HCT sonrası sHH/MAS tanısı, ayırıcı tanı gerektiren sitokin salınım sendromu ve enfeksiyöz komplikasyonların
semptomlarıyla örtüşebilen hiperinflamasyonun klinik belirti ve semptomlarının gözlemlenmesini gerektirir. Tipik olarak, bu
semptomlar ateş, birden fazla soyda sitopeni ve çoklu organ yetmezliğini içerir. Enfeksiyon tedavisi görmüş hastalarda tanımlanmış bir
enfektif neden olmaksızın inatçı ateş veya kötülegen ateş, sHH/MAS için acilen tarama yapılmasını gerektirmektedir. (Karakike ve
Giamarellos-Bourboulis 2019). Serum ferritin, sHH/MAS'in uygun ve kolayca bulunabilen bir biyobelirtecidir ve tedaviye yanıtı
izlemek için de kullanılabilir.CAR-T hücre tedavisi, hem hematolojik hem de hematolojik olmayan maligniteler icin etkili bir tedavi
olarak ortaya çıkarken, hiperinflamasyonla sonuçlanan akut bir toksisite olan sitokin salınım sendromu (CRS) ile ilişkilidir.Hastalar,
düşük dereceli yapısal semptomlardan çoklu organ disfonksiyonu ile yüksek dereceli sistemik hastalığa kadar bir dizi şiddette CRS ile
başvurabilirler ve en şiddetli haliyle, CRS şiddetli sHLH/MAS'A ilerleyebilir.Neelapu ve diğerleri CAR-T hücre tedavisi sonrası CRS'li
hastalarda sHLH/MAS için pik serum ferritin ölçümünü >10,000 μg/L ve aşağıdaki bulgulardan ikisini gösteren tanı kriterleri önerdi: a
derece >3 serum transaminaz veya bilirubin derecesinde artış > 3 oligüri veya serum kreatininde artış; derece > 3 pulmoner ödem veya
kemik iliği veya organlarda hemofagositozun histolojik kanıtı (Neelapt ve ark. 2018) (Tablo 30.1 ve 30.2).
SHLH/MAS'ın etkili tedavisi için hiperinflamatuar durumu kontrol etmek için agresif immünosupresyon gereklidir.Hızlı tanıma
ve tedavi önemlidir ve mortaliteyi azaltır. Kortikosteroidler, hastaların yarısından fazlası steroide dirençli olmasına rağmen indüksiyon
tedavisinin temel taşı olmaya devam etmektedir (Fukaya ve ark. 2008) (Tablo 30.3).Bir IL-1 antagonisti olan Anakinra, dirençli sHLH/
MAS'ta etkilidir ve sepsisli hastalarda nispeten güvenlidir (Shakoory ve ark. 2016) (Eloseily ve ark. 2019). Bu nedenle anakinra,
refrakter SHLH/MAS için kullanılmıştır ve şiddetli sHLH/MAS'lı hastalarda yetişkin sHLH/MAS'ında etkili olduğu bulunmuştur.
İntravenöz immünoglobulin (IVIG) infüzyonları da steroide dirençli ve sHLH/MAS'le tetiklenen enfeksiyonda (EBV) etkili olabilir
(Chen ve ark. 1995). Bu sendromun heterojenliğini kabul eden SHLH/MAS için bir tedavi protokolü yakın zamanda yayınlanmıştır.


Birinci basamak tedavi 3-5 gün süreyle intravenöz metilprednizolon (IVMP) 1g/gün artı 2 gün süreyle IVIG 1 g/kg olup, 14.
günde tekrarlanabilir.Yerleşik sHLH/MAS veya klinik bozulma kanıtı varsa, anakinra günde 1-2 mg/kg eklenir, günde 8 mg/kg kadar
arttırılabilir.CSA, erken veya steroide dirençli hastalık için düşünülür.Etoposid refrakter vakalarda düşünülmelidir, ancak CAR-T hücre
tedavisini takiben sHLH/MAS'lı hastalarda önceden var olan sitopeniler nedeniyle sorunlu olabilir.Ek olarak, EBV, bakteriyel
enfeksiyon veya altta yatan malignite, özellikle lenfoma gibi tetikleyiciler taranmalı ve yeterince tanımlanmışsa tedavi edilmelidir
(Vatsayan ve ark. 2016).
CAR-T Hücre Tedavisi Uygulanan Hastalar İçin Dikkat Edilmesi Gereken Hususlar
Önemli Noktalar:
31. BÖLÜM : ICU
Udo Holtick ve Elie Azoulay
CAR-T hücre tedavisi, hematoloji servislerinin yapısını ve kapasitesini zorlayan ve düzenli aralıklarla yoğun bakım ünitesine hasta
transferini gerektiren önemli yan etkilerle birlikte gelir. Hayatı tehdit eden advers olaylar, uygulamadan sonra saatler veya günler içinde
ortaya çıkabilen sitokin salıverme sendromu ve immün efektör hücre ile ilişkili nörotoksisite sendromunu içerir.Sepsis, bu yüksek riskli
immün sistemi baskılanmış hastalarda CAR-T infüzyonunu takip eden günlerde yoğun bakım ünitesine kabul edilmesini de
gerektirebilir.CAR-T tedavisi alan hastaların yönetiminde kritik bakım ve YBÜ uzmanları önemli bir rol oynamaktadır. Önemli sayıda
hasta yoğun bakım yatağına ihtiyaç duyar ve CRS, yoğun bakıma kabulün önde gelen nedenidir (Fitzgerald ve ark. 2017; Gutierrez ve
ark. 2020).Hızlı ve uygun YBÜ yönetimi, hematologlar ve YBÜ uzmanları arasında ince ayarlanmış bir diyaloğa ve yoğun bakım
ünitesine kabulü hedeflemek için eşik momentinin uygun bir tanımına dayanır. Bu nedenle hastaların yarısından azında yüksek doz
vazopressörler, mekanik ventilasyon veya renal replasman tedavisi gerekir (Azoulay ve ark. 2020).Bununla birlikte, kritik bakım,
uygun antibiyotiklerin, sepsisin kaynak kontrolünün, eko kılavuzluğunda sıvı genişlemesinin, akut böbrek hasarının önlenmesinin ve
optimal bir oksijenasyon stratejisinin sağlandığı kişilere de yarar sağlar.Komorbiditesi olan bazı hastalarda, YBÜ uzmanlarının rolü,
hastanın CAR-T hücre tedavisine uygunluğu ile başlar. Hastanın kırılganlığının ve organ disfonksiyonu ve sepsis gelişme riskinin
değerlendirilmesi, yoğun bakım ünitesine kabulün optimal zamanlamasını tanımlamaya yardımcı olur.Hastalar lenfodeplesyona
başladığında, yoğun bakım uzmanları en azından bir iletim alır.
Tabii ki, hastalarda kalıcı evre 1 veya evre 2 CRS olması durumunda yine YBÜ (yoğun bakım ünitesi) uzmanı uyarılır. Genel olarak, bu dikkatli stratejiler YBÜ'ye yatış gereksiniminin azalmasını sağlamış ve sayılar, YBÜ yataklarının az olduğu bir ortamda faydası olan hücre tedavisinin ve immünoterapinin dünya çapında yaygın kullanımı ile desteklenmiştir.
CAR-T alan hastaları en iyi şekilde yönetebilmek için hematologların, onkologların ve yoğun bakım uzmanlarının gerekli bilgi ve becerileri edinmeleri gerekmektedir. Transdisipliner toplantılar, hasta yönetiminin uyum içinde yürütülmesini kolaylaştırarak tüm katılımcıların diğer uzmanlık alanlarındaki gelişmelerden haberdar olmasını sağlar. Yakın zamana kadar, yoğun bakım üniteleri öncelikli olarak kanserli hastaları iyileştirmek için bir köprü olarak kullanılıyordu (Azoulay ve arkadaşları, 2017; Gray ve arkadaşları, 2021). Ancak CAR-T hücre tedavisi; altta yatan refrakter maligniteye rağmen her CAR-T hücre alıcısına sınırlı zamanda sunulan bir deneme üreterek bu kavramlara meydan okumakta ve tamamen remisyona girme veya umut vaat eden başka bir tedaviye geçme yönünde önemli umutlar beslemektedir. Bununla birlikte, tüm hastalar CAR-T hücreleri ile tedaviye yanıt vermez ve birçok hastada en sonunda nüks eder. Bu nedenle, YBÜ'ye kabul ve taburcu yaklaşımını belirsizlik bağlamında ve iyileşme umudu ile uyarlamamız gerekecektir.
Aşağıdaki kilit noktalar, CAR-T hücre alıcısının yolculuğu boyunca YBÜ uzmanının rolünü vurgulamakta ve ilgili uzmanlık alanları arasında sıkı işbirliğinin sürdürülmesinin önemini ortaya koymaktadır.
Önemli Noktalar:
CAR-T hücre tedavisi: Multidisipliner işbirliğini vurgulayan sistem.
Azoulay E. ve arkadaşlarından uyarlanmıştır, Am J Respir Crit Care Med. 2019
32.BÖLÜM: CAR-T HÜCRE TEDAVİSİ SONRASI (GÜÇLENDİRME VE NÜKS ETME): AKUT LENFOBLASTİK LÖSEMİ -32-
Jordan Gauthier
CD19 CAR-T hücre tedavisi sonrası minimal rezidüel hastalık-negatif (MRD) tam remisyondaki (CR) B-hücreli akut lenfoblastik lösemi (B-ALL) hastalarında konsolidatif allojenik hematopoetik hücre transplantasyonunun (allo-HCT) rolü.
CD19 CAR-T hücre tedavisinden sonra MRD-negatif CR elde edilen B-ALL hastalarında konsolidatif allo-HCT'nin rolü hala tartışılmaktadır. Nükseden veya dirençli (R/R) B-ALL'li çocuk ve genç yetişkinlerde "tisagenlecleucel" i araştıran ELIANA klinik çalışmasının son güncellemesinde, medyan gerileme süresi ve genel sağkalıma ulaşılamamıştır (medyan takip, 24 ay). Yanıt verenlerde 24 aylık nüksetmeden sağkalım olasılığı %62 olmuş ve olasılık eğrileri 1 yıl sonra plato çizmiştir (Grupp ve arkadaşları, 2019). CR hastalarının sadece %9'unda allo-HCT ile konsolidasyon bildirilmiştir; bu da tisagenlecleucel ile tek başına CD19 CAR-T hücre tedavisinin pediyatrik hastaların önemli bir kısmında tedavi edici olabileceğini düşündürmektedir. Buna karşın, bugüne kadarki veriler CD19 CAR-T hücre tedavisinin R/R B-ALL'li yetişkinlerin çoğunda kesin bir yaklaşım olduğunu göstermemektedir. Yetişkin B-ALL'liler için CD19 CAR-T hücre tedavisinin ana akademik ve endüstri destekli klinik çalışmalarında medyan yanıt süreleri 8 ile 19 ay arasında değişmektedir ve tedaviden sonra CR'de konsolidatif allo-HCT alan hastaların oranında önemli farklılıklar vardır (%35-75). (Shah ve arkadaşları, 2019; Frey ve arkadaşları, 2020; Hay ve arkadaşları, 2019; Park ve arkadaşları, 2018) Deneyimlerimize göre, tanımlanmış-kompozisyon CD19 CAR-T hücre tedavisinden sonra MRD-negatif CR'de iken allo-HCT uygulanan hastalarda, 2 yıllık EFS ve OS olasılıklarında sırasıyla %61 ve %72 oranında olumlu sonuçlar gözlemledik. Hasarsız sağkalım (EFS; lenfodeplesyon öncesi LDH konsantrasyonu ve trombosit sayısı, siklofosfamidfludarabin lenfodeplesyonu) için daha önce tanımlanmış prognostik faktörler ayarlandıktan sonra, allo-HCT için tehlike oranı 0,39 (%95 CI 0,13-1,15, p=0,09) olmuştur ve bu da EFS üzerinde faydalı bir etki olduğunu düşündürmektedir. Bu bulgulara dayanarak, yetişkin hastalardaki yaklaşımımız, CD19 CAR-T hücre tedavisinden sonra MRD-negatif CR'deki R/R B-ALL' li yetişkin hastalarda konsolidatif allo-HCT önermektir. Ek olarak, hasta yaşı ve tercihleri, komorbiditeler, önceki nakil öyküsü ve MRD dikkate alınmalıdır. NCI/NIH (Lee ve arkadaşları, 2016) ve Seattle Çocuk Hastanesi'nden (Summers ve arkadaşları, 2018) araştırmacılar, CD19 CAR-T hücre tedavisinden sonra allo-HCT ile konsolide edilen çocuk ve genç yetişkinlerde sağkalım avantajı olduğunu bildirmiştir. Ancak, bugüne kadar elde edilen verilerin randomize olmayan retrospektif analizlere dayandığı ve potansiyel olarak önemli önyargılara tabi olduğu unutulmamalıdır (Suissa 2007, Lévesque ve arkadaşları, 2010).
CD19 CAR-T Hücre Tedavisi Sonrası Nükseden B-ALL'nin Yönetilmesi
CD19 CAR-T Hücre Tedavisi Sonrası CD19-Pozitif Hastalık
Dondurulmuş son üretim CAR-T hücreleri mevcutsa ve hedef antijen hala açıksa, ikinci bir CAR-T hücre ürünü üretmek için "artık" hücreleri kullanmak cazip bir yaklaşımdır. İkinci CD19 CAR-T hücre infüzyonlarının uygulanabilir olduğunu ve iyi tolere edildiğini, ancak murin tek zincirli değişken fragman (scFv) CAR alanına yönelik çoğu vakada antitümör etkinliğin anti-CAR immün yanıtlarla sınırlı olduğunu gösterdik. İlk CAR-T hücre infüzyonundan önce siklofosfamid ve fludarabin lenfodeplesyon uygulanan ve daha yüksek bir CAR-T hücre dozu (ilk CAR-T hücre infüzyonundan 10 kat daha yüksek) alan hastalarda daha iyi sonuçlar gözlemledik. Bununla birlikte, ikinci CAR-T hücre infüzyonları 14 ALL hastasının sadece 3'ünde (%21) CR elde etmiştir (Gauthier ve arkadaşları, 2020). Anti-CAR immün yanıtlarını, insanlaştırılmış veya tamamen insan scFv'leri içeren bir CAR kullanarak hafifletme veya atlatma çalışmaları devam etmektedir (Gauthier ve arkadaşları, 2018; Brudno ve arkadaşları, 2020). Maude ve arkadaşları, 38 çocuk ve genç yetişkinde insanlaştırılmış scFv taşıyan CD19 CAR-T hücre ürünü CTL119'un kullanımını değerlendirmiştir (Grupp ve arkadaşları, 2015). Murin CAR'a maruz kalan hastalarda (%43), CAR-naive popülasyona (%100) kıyasla daha düşük bir oranda da olsa MRD-negatif CR elde edilebilmiştir. Yanıt veren hastalarda 12 aylık tekrarsız sağkalım olasılıkları CAR-exposed ve CAR-naive kohortlarında sırasıyla %82 ve %56 olmuştur. Başka bir raporda, Cao ve arkadaşları daha önce murin CD19 CAR-T hücrelerine maruz kalan 3 hastanın 2'sinde CR gözlemlemiştir (Cao ve arkadaşları, 2019). Murin CAR'a maruz kalınan ortamlarda tam insan veya insanlaştırılmış scFv kullanan CD19 CAR-T hücresinin düşük etkinliğinin altında immünojenisite, zayıf CAR-T hücre fonksiyonu veya hastalıkla ilgili faktörlerin yatıp yatmadığını belirlemek için daha ileri çalışmalara ihtiyaç vardır.
CD19 CAR-T Hücre Tedavisi Sonrası CD19-Negatif Hastalık
CD22-hedefli CAR-T hücreleri kullanımıyla, önceki CD19 CAR-T hücre tedavisinden sonra CD19-negatif B-ALL blastları olan hastalar da dahil olmak üzere, umut verici sonuçlar alınmıştır. Shah ve arkadaşları, daha önce bir CD19 CAR-T hücre ürünü ile tedavi edilen hastaların %62'si de dahil olmak üzere, R/R B-ALL'li 58 çocuk ve genç yetişkindeki deneyimlerini aktarmışlardır (Shah ve arkadaşları, 2020).
R / R 13-TÜMÜ, daha önce bir CDI 9 CAR-T hücre ürünü ile tedavi edilen hastaların %62'si dahil (Shah ve ark. 2020). CD22 CAR-T hücreleri, vakaların %61'inde MRD-negatif CR elde etti ve ortanca yanıt süresi 6 aydı. (35 MRD negatif CR hastasının 13'ü (%37) allo-HC1 almaya devam etti). Daha önce CD19 CAR-T hücreleri ile tedavi edilen hastalarda MRD negatif CR oranı %64 idi. Pan ve diğerlerinin bir başka raporunda, 34 çocuk ve yetişkin hastaya CD22 CAR-T hücreleri uygulandı. Hastaların %91'inde CDI 9 CAR-T hücre tedavisinin önceki başarısızlığı belgelendi. CD22 CAR-T hücreleri, hastaların %76'sında MRD-negatif CRS elde etti. Yanıtlar dayanıklıydı ve CR hastalarında 1 yıllık lösemisiz sağkalım olasılığı %58 idi (30 CR hastasının 11'i [%37] allo-HCT almaya devam etti) (Pan ve ark. 2019).
Önemli Noktalar:
• Mümkün mertebe CD19 CAR-T hücre tedavisinden sonra MRD-negatif CR'de R/R BALL’U olan yetişkin hastalara alto-HCT önerilmelidir.
• CD22 CAR-T hücreleri, CD19 CAR-T hücre yetmezliğinden sonra yüksek yanıt oranları ile ilişkilidir ve en dayanıklı yanıtlar, konsolide allo-HCT'den sonra takıntılıdır.
• Tamamen insan veya hümanize scFv'ye sahip CD19 CAR-T hücreleri, anti-CAR bağışıklık tepkilerini azaltmak için araştırılıyor ve tekrarlanan CAR-T hücre infüzyonlarının etkinliğini potansiyel olarak engelliyor.
33.BÖLÜM: Post-CAR-T Hücresi Terapisi (Konsalidasyon ve Nüks Etme): Lenfoma
Didier Bliaise ve Sabine Furst
On yıllık kullanımdan sonra bile, non-Hodgkin lenfoma (NHL) için CAR-T hücre tedavisi hala gelişmektedir ve deneyimli merkezlerin çoğunda hastalık kontrolü artık ana endişe kaynağıdır. Gerçekten de, refrakter hastalarda son derece çekici objektif yanıt (OR) oranlarına rağmen, bu popülasyonun uzun vadeli genel sağkalımı (OS) yalnızca biraz kanıtlanamamıştır. Önemli çalışmalar, tedaviden sonraki ilk 3 ay içinde tam yanıt (CR) elde edildiğinde sonuçlar iyileşse de 2 yıllık OS oranlarının %30'u geçmediğini öne sürdü. (Wang ve ark. 2020; Schuster ve ark. 2019; Neelapu ve ark. 2017) Bu son derece yüksek OR seviyesine ulaşılması takdire şayan olsa da işletim sistemi ile ilgili benzer iyileştirmeler yapılmamıştır ve mevcut işletim sistemi olasılıkları tatmin edici değildir. Elbette bunun birden çok nedeni var; hastaların önemli bir oranı ya bir başlangıç yanıtı elde etmez ya da tedaviden hemen sonra kötü OS ile progresyon yaşar (Chow ve ark. 2019). Her iki popülasyon da CAR-T hücre tedavisinden önce hastalık yükü veya agresif kanser ile kendini gösterir, muhtemelen tedavi sürecinde çok geç sevk edilmiş veya CAR-T hücrelerinin onlar için işlenmesinden önce çok uzun süre beklemiştir. Bu sorunların her ikisinin de daha erken bir aşamada yönlendirmeleri artırabilecek CAR-T hücrelerinin etkinliğinin daha geniş çapta duyurulması ve üretim sürecini kısaltmak için hâlihazırda yoğun bir şekilde araştırılan yöntemlerin geliştirilmesi gibi potansiyel çözümleri vardır (Rafiq ve ark. 2020) İkinci durumda, allojenik lenfositlerin kullanımı, önceden hazırlanmış hücrelerin ihtiyaç duyulduğunda kolayca kullanılmasına izin verebilir ve büyük olasılıkla, graft-versus-host hastalığı riski dengelendiği sürece en etkili strateji olacaktır (Graham ve Jozwik 2018). Bu nedenle kısmi yanıt (PR) veya stabil hastalığı (SD) olan hastalar daha düşük OS ile mevcut olduğundan, CR'ye ulaşmak OS'yi artırmada çok önemli bir adımdır, şu anda CR 6 aydan uzun süre devam ettiğinde nüks nadir görünmektedir (Koanduri 2021)
Bununla birlikte, muhtemelen CAR-T hücrelerinin zayıf kalıcılığı gibi sorunlar nedeniyle (akut lenfoblastik lösemi için bir zamanlar düşünüldüğü kadar önemli olmayabilir (Komanduri 2021)), hastalık muhtemelen hastaların yarısından fazlasında tedaviyi takip eden aylarda tekrarlayacaktır.) veya hedef antijen ifadesinin kaybı (düzenli olarak belgelenmiştir (Rafiq ve ark. 2020Bu mekanizmaların her ikisi de potansiyel olarak CAR-T hücre tedavisinden sonra nüksü azaltan yöntemler geliştirmek için kullanılabilir. Aslında, şu anda araştırılan en popüler yaklaşımlar, ya her biri farklı antijenleri hedefleyen iki CAR-T hücre tipini kullanmaya çalışmak ya da birden fazla antijeni veya CD19'dan farklı bir antijeni hedefleyen CAR-T hücre yapısı oluşturmaktır (Shah ve ark. 2020). CAR-T hücrelerinin hedefe yönelik tedavilerle eşzamanlı infüzyonu, diğer B hücreli malignitelerde de araştırılmaktadır ve hem CR oranını artırdığı hem de nüksü azalttığı görülmektedir (Gauthier ve ark. 2020). Nüks meydana geldiğinde, hastanın OS'si oldukça iç karartıcıdır ve kalan en iyi seçenek, büyük olasılıkla bir klinik araştırmaya dahil edilmesi olacaktır. Bu seçenek mevcut değilse kurtarma tedavisi denenebilir, ancak çoğu hastalık immünoterapiden önce çok sayıda tedaviye dirençli olduğundan sitotoksik tedaviler son derece sınırlıdır. Anti-PD-1 antikorları, ibrutinib veya ImiD'ler alan küçük bir hasta popülasyonuna sahip birkaç vaka raporu ve çalışması, büyük ölçüde anekdot niteliğinde destekleyici kanıtlarla bildirilmiştir (Byrne ve ark. 2019). Bununla birlikte, yeni bir nesnel yanıt (OR) durumunda bile, müteakip nüks riski önemlidir ve hali hazırda tedavi edilen hastalarda gerçekleştirilmiş olan allojenik hematopoietik kök hücre transplantasyonu (Byrne ve ark. 2019) ile daha fazla konsolidasyona neden olabilir. akut lenfoblastik lösemi (Hay ve ark. 2019). Bununla birlikte, bu stratejinin etkinliği klinik deneylerde NHL hastalarında onaylanmayı bekliyor. Sınırlı da olsa, bir OR'yi indükleyen CAR-T hücreleriyle ek bir tedaviyle ilgili olarak yakın zamanda daha fazla destekleyici kanıt rapor edildi. Çalışmaya dahil edilen 21 NHL hastasında, ikinci infüzyondan sonraki OR oranı %52'dir (CR, n = 4; PR, n = 7), bazı kalıcı yanıtlar daha ileri araştırmaları gerektirir (Gauthier ve ark. 2021). Genel olarak, nüks sonrası bu kadar kötü sonuçlarla birlikte, mevcut çabalar aynı zamanda hastalık ilerlemesi yaşama olasılığı en yüksek olan ve önleyici konsolidasyon tedavisi için potansiyel adaylar olan hastaları tahmin etmeye odaklanmıştır, ancak hızlı bir CR elde etmeyen hastaların ilk adaylar olması gerektiğine şüphe yoktur. Ek olarak, bağışıklık izleme yalnızca CAR-T hücre sağkalımını değil, aynı zamanda dolaşımdaki tümör DNA'sının tespitini de kapsamalıdır (Komanduri 2021), çünkü bu, subklinik nüksü tespit etmeye ve konsolidasyon veya idame tedavisinin uygulanıp uygulanmayacağına karar vermeye yardımcı olabilir. Bununla birlikte, şu anda, tüm bu yaklaşımlar oldukça spekülatiftir ve daha fazla klinik çalışma gerektirir.
Önemli Noktalar:
• NHL için CAR-T hücre tedavisinden sonra nüks, iç karartıcı bir sonuçla ilişkilidir. Şu anda, kurtarma tedavisi konusunda bir fikir birliği yoktur.
• Nüksü önlemek için yöntemlerin araştırılması zorunludur.
•Dahil etme klinik çalışmalarda tavsiye edilir.
34. BÖLÜM: CAR-T Sonrası Hücre Tedavisi (Konsolidasyon ve Nüks): Multipl Miyelom
BCMA-güdümlü otolog CAR-T hücreleri ile benimsenen hücre tedavisi son dönem relaps ve refrakter multipl miyelomda (MM) çok ümit verici sonuçlar göstermiştir, ide-cel (idecabtagene autoleucel, KarMMa) ve cilta-cel (ciltacabtagene autoleucel, CARTITUDE 1) ile ilgili bugüne kadar yapılan en büyük iki çalışmada 2. fazda; genel yanıt oranları 73% ile 96.9%, tam yanıt (CR) oranları 33% ile 67.9% ve MRD negatifliği 50-74% arasında hasta rapor edildi (Madduri et al. 2020; Munshi et al. 2021). Ne yazık ki, yanıtlar genellikle korunmaz ve hayatta kalma eğrilerinde henüz bir plato görülmedi. ide-cel'in KarMMa çalışmasında medyan progresyonsuz sağkalım (PFS), infüze edilen 128 hastanın tamamında 8,8 aydı (%95 CI, 5,6-11,6) , en yüksek dozu (450 x 10⁶ CAR + T hücreleri) alan hastalar arasında 12,1 aya (%95 CI, 8,8-12,3) ve CR elde edenler arasında 20.2 aya (%95 CI, 12.3-NE) yükseldi. CARTITUDE-1 çalışmasında medyan takip süresi 12,4 ay iken medyan PFS'ye ulaşılamamış ve 12 aylık PFS oranı %76,6 (%95 CI; 66,0-84,3) olmuştur. PFS’de net bir platonun olmaması şu anda onaylanmış CD-19 yönlendirmeli CAR-t hücreleri ile DLBCL veya B-ALL'de gözlemlenenden ayıran şey, burada (daha kısa PFS ve daha düşük CR oranlarına rağmen) 6 aydan fazla nüksetmeden kalan hastaların uzun süreli hastalık kontrolünden yararlanmaları ve hatta iyileşmeleri muhtemel olmasıdır.
MM'de CAR-T hücre tedavisini takiben direnç ve nüks mekanizmaları tam olarak anlaşılamamıştır ve hayatta kalmadaki bu farklılıkları birkaç faktör açıklayabilir (D'Agostino ve Raje 2020; Rodríguez-Otero et al. 2020). MM, önemli klonal heterojeniteye ve oldukça düzensiz kemik iliği mikro ortamına sahip çok heterojen bir hastalıktır. Ek olarak, CAR-T hücre tedavisi, çok ağır bir şekilde ön tedavi görmüş popülasyonlarda değerlendirilmiştir; hastaların önemli bir oranı, (Burdan sonrası sonraki sayfanın) üçlü sınıf refrakterdir ve mevcut tedavilere maruz kalmaktadır; bu, beklenen PFS'si 4 aydan az olan tedavisi zor bir popülasyonu yansıtmaktadır. (Gandhi et al. 2019).
Tepkileri sürdürmek ve yaşam süresini uzatmak ,antijen kaybını önlemek için ikili hedefleme gibi (Jiang et al.2020) farklı stratejiler araştırılmaktadır. Cevapları birleştirmek için en gelişmiş strateji, işlevsel Car-T hücresi kalıcılığını artırmak ve yorgunluğu önlemek için IMIDs veya kontrol noktası inhibitörleri gibi immünostimülasyonlu ilaçlarla kombinasyondur.Bu stratejileri kullanan birkaç klinik çalışma devam etmektedir
İlginç bir şekilde, Car-T hücre tedavisi sonrası nüks göz önüne alındığında, ortaya çıkan veri PFS ve genel hayatta kalma (OS) arasında bir uyumsuzluk gösterir.CRB-401 fazından güncellenen sonuçlarda, median PFS ve OS rapor edilen medyan PFS 8.8 (%95 CI 5.9-11.9) ve 34.2 (%95 CI, 19.2-NE) aylar sırasıyla tüm dozlarda (Lin ve al. 2020). KarMMa çalışmasında OS verileri hastaların %66’sıbin denetimde olmasıyla (Munshi ve al. 2021) hala gelişmemiştir.Şimdiye kadar PFS ve OS arasındaki bu aralık diğer calişmalarda bu kadar açık değil.Ancak takip süresi denemelerin çogu için hala çok kısa.Daha uzun takip süresine sahip BCMA çalışmalarından biri olan Legend-2 çalışmasında, tedavi edilen tüm hastalar için ortanca PFS 20 ay, ortanca OS ise 18 aylık OS oranı% 68 ile ulaşılamadı (Chen et al. 2019).Bu CAR-T hücre tedavisinden sonra nükseden MM hastaları, daha önce başarısız olan ilaç kombinasyonları da dahil olmak üzere kurtarma tedavilerine yanıt verebilir olduğunu gösteriyor. Bağışıklık sisteminin veya CAR-T hücrelerinin neden olduğu kemik iliği mikro ortamının potansiyel modifikasyonları hakkında spekülasyon yapılabilir.Maalesef, bu fenomeni ele alan veriler henüz mevcut değildir.Ayrıca, CAR-T hücre tedavisinin sağlıkla ilgili yaşam kalitesini önemli ölçüde iyileştirdiği gösterilmiştir.(Cohen et al. 2020; Martin III et al. 2020; Shah et al. 2020)Ve bu kadar iyi fiziksel durum, uzun süredir tedavi serbest aralığı ile birlikte, hastaların, OS kazançına katkıda bulunan ek kurtarma terapilerini kabul etmeye teşvik edebilen iki kilit faktördür.
Ne yazık ki, CAR-T hücresi ilerlemesinden sonra hangi optimal kurtarma tedavilerinin önerilmesi gerektiğini açıklamak için veriler henüz mevcut değildir. BCMAya yönelik CAR-T hücresi infüzyonundan sonra ilerleyen ve daha sonra belantamab mafodotin veya kontrol noktası inhibitörleri gibi diğer BCMA ajanları ile tedavi edilen hastaların anekdot vakaları bildirilmiş ve bu yaklaşımın sınırlı etkinliğe sahip olduğunu gösterir.(Cohen et al. 2019).Bununla birlikte, bcma’ya yönelik CAR-T hücre terapisinde başarısız olan hastalarda optimal yaklaşım, farklı etki mekanizmalarına sahip terapiler (Melflufen, CELMODs, Selinexor) veya SLAMF7, GPRC5D veya FcRH5 gibi farklı hedeflere yönelik immünoterapiler,bispesifik T hücresi etkileşicileri (Talquetamab veya Cevostamab) hatta CAR-T hücreleri kullanılarak olacaktır.Gerçekten de, yeni tedavi yöntemleri ve CAR-T hücre tedavisinden sonra nükseden hastalar da dahil olmak üzere erken evre çalışmalarından elde edilen veriler, bu zorlu sorunun cevabını sağlayacaktır: BCMA CAR-T hücre tedavisini takiben: daha fazla yaşam için umut.
Önemli Noktalar
35.BÖLÜM: BAĞIŞIKLIK TAKİBİ
Susanna Carolina Berger, Boris Fehse ve Marie-Thérèse Rubio
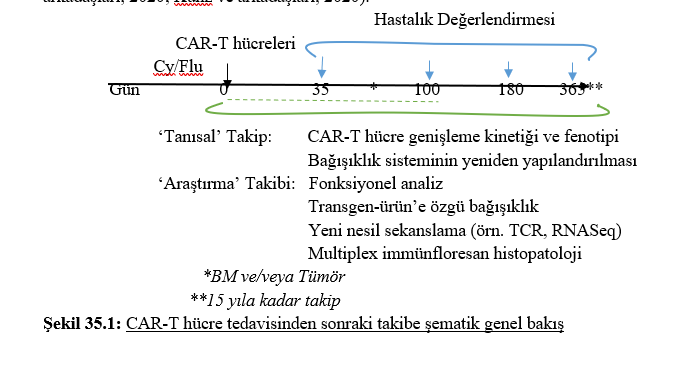
CAR-T hücre genişlemesi ve kalıcılığı, terapötik etkinlik ve toksisite için kritik parametrelerdir (Locke ve arkadaşları, 2020). Ancak CAR-T hücreleri, in vivo genişleme kabiliyeti öngörülemeyen hastalara özgü 'canlı ilaçlardır'. Bu nedenle, yakın postinfüzyon izleme, bu tedaviyi daha iyi yönetmek için önemli bir ön koşul olmalıdır. Kritik parametreler arasında CAR-T hücre genişleme kinetiği ve fenotipi, immün rekonstitüsyon ve serum biyobelirteçleri yer almaktadır (Şekil 35.1; Kalos ve arkadaşları, 2011; Hu ve Huang, 2020). Ayrıca, özel araştırma merkezlerinde gelecekteki hipotez odaklı çalışmalar için hasta örneklerinin prospektif olarak toplanması ve saklanması planlanmalıdır. Bugüne kadar, CAR-T hücre tedavisinin hızla yaygınlaşmasına rağmen, CAR izlemesi için standart öneriler mevcut değildir ve birden fazla merkezdeki faaliyetlerin birbirleriyle uyumlu hale getirilmesine acilen ihtiyaç duyulmaktadır.
CAR-T Hücrelerinin Dijital PCR (dPCR) ile Moleküler Takibi
Klinik olarak kullanılan CAR-T hücre ürünlerinin çoğu, ilgili CAR yapısını kodlayan retro- veya lentiviral vektörlerle stabil olarak transdüklenmiş otolog lenfositlerden oluşur. Entegre CAR vektörleri genellikle eş zamanlı kantitatif PCR (qPCR) veya dPCR kullanılarak genomik düzeyde tespit edilir. Şaşırtıcı bir şekilde; klinik çalışmaların dışında, CAR'a özgü tanı araçları başlangıçta eksikti ve CAR-T hücrelerini in vivo olarak saymak için laboratuvar yapımı spesifik testlerin de novo tasarımını gerektiriyordu (Badbaran ve arkadaşları, 2020; Fehse ve arkadaşları, 2020; Kunz ve arkadaşları, 2020).
Teknolojik farklılıklara rağmen qPCR ve dPCR testleri, numune kalitesine ilişkin sınırlı gerekliliklerle birlikte sağlam ve doğru sonuçlar verir (Tablo 35.1).
dPCR son derece hassastır ve standart eğrilere veya çoklu tekrarlara dayanmaz. Bir dezavantaj olarak, DNA'ya yönelik PCR izleme, CAR yapısının ekspresyonu hakkında hiçbir bilgi sağlamaz. Bununla birlikte, CAR-T hücrelerinin genişlemesi büyük ölçüde CAR'ın kendisiyle ilişkili (kognat) antijenle etkileşimine bağlıdır. Buna uygun olarak, verilerimiz dPCR ile akış sitometrisi (Badbaran ve arkadaşları, 2020) ve klinik (Ayuk ve arkadaşları, 2021) sonuçlar arasında mükemmel bir korelasyon olduğunu göstermiştir. Akış sitometrisi tabanlı testler CAR-T hücrelerinin fenotipik karakterizasyonunu kolaylaştırdığından, iki yöntem birbirini iyi bir şekilde tamamlamaktadır.
CAR-T Hücrelerinin Akış Sitometrisi ile Takibi
CAR-T hücrelerinin akış sitometrisi (CMF) ile tanımlanması, CAR'ı (idiotip, bağlayıcı bölge) veya CAR yapısında bulunan belirli bir etiketi doğrudan tanıyan monoklonal antikorlar (mAbs) kullanılarak gerçekleştirilebilir. Alternatif olarak, bir insan IgG Fc fragmanına kaynaşmış CAR hedef antijenini içeren antijen-Fc kimerik proteinler kullanılarak dolaylı tespit sağlanabilir. Bir florokrom ile etiketlenmiş bir anti-Fc veya anti-biyotin (antijen-Fc biyotinlenmişse) mAb ile CAR eksprese eden hücrelerin tespiti için ikincil bir boyama adımı gereklidir (Hu ve Huang 2020). Ticari CD19 CAR-T hücreleri alan hastalar, klinik çalışmalar dışında pratikte iki aşamalı bir boyama protokolünde biyotinlenmiş CD19-Fc proteinleri ile izlenir. CMF'nin avantajı; CAR-T hücrelerini T hücresi alt tipi (CD4 ve CD8 ekspresyonu), farklılaşma (naif ve hafıza) ve tükenme (PD1, TIM3, Lag3) açısından karakterize etmek için CAR boyamasını diğer hücre yüzeyi belirteçleriyle birleştirme olasılığıdır. Ayrıca sonuçlar hekimlere eş zamanlı olarak sunulabilmektedir. Tekniğin dezavantajı nispeten düşük hassasiyetidir. T hücrelerinin %0,5'inin altında CMF'nin güvenilirliği zayıftır ve PCR yoluyla takip edilmesini gerektirir. Hücre infüzyonundan sonra periferik kandaki CAR-T hücrelerinin sıralı CMF analizi ile iki önemli bilgi elde edilmektedir:
|
Tablo 35.1 Moleküler izleme araçlarının karşılaştırılması |
||
|
|
qPCR |
dPCR |
|
Analiz prensibi |
||
|
Hedefe özel primer ve floresan problar |
Evet |
Evet |
|
Örnek içindeki ilgilenilen genin analizi |
Nüfus düzeyinde |
Küçük damlacıklara bölündükten sonra |
|
Amplifikasyon |
PCR döngüleri üzerinden amplikonu güçlendirir ve nicelendirir |
Amplikonu bir damlacık içinde ayrı ayrı yükseltir ve nicelendirir |
|
Miktar belirleme |
Sürekli ara floresan ölçümleri |
Uç nokta floresansına dayanır |
|
Veri sağlamlığı ve güvenilirlik |
Yüksek |
Çok yüksek |
|
Referans numune/standart eğri gereksinimi |
Evet |
Hayır |
|
Tek hücre araçları |
Hayır |
Evet |
|
Genel özellikler |
||
|
Enstrümanların dağılımı |
Yaygın olarak kullanılabilir |
Hala daha az sıklıkla mevcut |
|
Kullanma |
Uygulaması kolay |
Daha fazla eğitim gerektirir & teknik beceri |
|
Maliyet (Campomenosi et al.2016)b |
Numune başına 3,33 € |
Numune başına 3,66 € |
|
çoğullama |
Evet |
Evet |
|
Ticari olarak temin edilebilen sertifikalı enstrümanlar |
Evet |
Evet(sınırlı) |
"qPCR ile karşılaştırıldığında, çok sağlam amplifikasyon kinetiği ve amplifikasyon gürültüsünü bastırır "Belirtilen çalışmada, numune başına maliyetler, dPCR için tekli ölçümlere karşı qPCR için üçlü analizlere dayanıyordu. Araç amortismanını dahil etmediler Örnek/reaktif kullanımını ve pipetleme gürültüsünü azaltır, verimi artırır
Hücre infüzyonundan sonra periferik kandaki CAR-T hücreleri: genişleme zirvesi (Cmax, yüzde veya mutlak değer olarak maksimum CAR-T hücre oranı) ve DO ve D28 (AUC0-28) arasında dolaşan CAR-T hücrelerinin eğrisinin altındaki alan. Bu iki parametre, B-lenfoid malignitelerde tedavi sonrası yanıt ve komplikasyon riski ile ilişkilendirilmiştir (Park ve ark. 2018; Fraietta ve ark. 2018; Locke ve ark. 2020; Ayuk ve ark. 2021). Bu parametreleri belirlemek için, CAR-T hücre izlemesinin önerilen sıklığı, CAR-T hücre uygulamasından sonraki ilk 2 hafta boyunca haftada iki veya üç kez, 21 ve 28. günlerde, CAR-T hücresini izleyene kadar ayda bir kezdir. 3 ayda bir ve daha sonra 1 yıla kadar her 3 ayda bir (Rubio ve ark. 2021).
Ek Bağışıklık Parametrelerinin İzlenmesi (CAR-T olmayan, B, ve NK Hücreleri ve Sitokinler)
Anti-CD 19 CAR-T hücreleri alan hastalar, uzun süreli T CD4 lenfopeni ve ayrıca ciddi hipogamaglo ulinemili B hücre aplazisi geliştirebilir, bu da onları hematopoietik iyileşmeden sonra bile bakteriyel ve viral enfeksiyonlara karşı özellikle duyarlı hale getirir (Logue ve ark. 2021). Bu nedenle, takibin ilk yılında CAR-T olmayan CD4 ve CD8 T hücreleri, B hücreleri ve NK hücreleri ile serum immünoglobulin düzeylerinin rutin immün sürveyansı önerilir.
CAR-T hücre uygulamasından sonra T lenfositlerin (IL-6, IFN-Y, sIL2-Ra, sIL-6R, GM-CSF IL-2 ve TNF-a) aktivasyonu sonucu çok sayıda sitokin üretilir. , mono-makrofajların aktivasyonu ve çekiciliği (IFNa, IL-1f IL-6, IL1Ra, IL10, IL-12, IL-13, IL-15, sIL6-R, TNF-a, CXCL10, CCL2 ve IL-8 ve doku hasarına yanıt olarak (IL-6, IL-8, G-CSF ve GM-CSF) (Brudno ve Kochenderfer 2019). Sepsis, CAR-T hücre genişleme derecesi ve tümör yükü gibi kafa karıştırıcı faktörler de sitokin seviyelerini etkiler. Bazı sitokin imzalarının, sitokin salıverme sendromunun (CRS) (Teachy ve ark. 2016), immün efektör hücre ile ilişkili nörotoksisite sendromunun (ICANS) (Santomasso ve ark. 2018) veya CAR-T'nin genişleme kapasitesinin ortaya çıkışını öngördüğü açıklanmıştır. hücre: in vivo (Kochenderfer ve ark. 2017). Klinik pratikteki önemli bir sınırlama, ciddi komplikasyonları öngören doğrulanmış bir hızlı sitokin miktar tayini testinin olmamasıdır. Bu nedenle, sitokinlerin komplikasyonların oluşumunu veya tedavi etkinliğini tahmin edip edemeyeceğini belirlemek için homojen hasta gruplarında daha ileri çalışmalara ihtiyaç vardır. CAR-T hücre analizinin her zaman noktasında prospektif çalışmalara katılım veya serum toplanması önerilir.
Önemli noktalar
CAR-T hücre tedavisinden sonra immün izleme dikkatli bir şekilde yapılmalıdır.
36.BÖLÜM: Uzun Vadeli Takip ve Geç Etkiler
Patrick Hayden, Nico Gagelmann ve John Snowden
CAR-T hücre tedavisinin uzun vadeli etkileri hakkında çok az şey bilinmektedir.
Sitopeni ve hipogamaglobulinemi gibi orta vadeli komplikasyonlar devam edebilir ve devam eden tedavi gerektirebilir, ancak bu yeni immünoterapötik sınıfa özgü başka kalıcı toksisiteler yok gibi görünmektedir (Fried ve ark. 2019; Cordeiro ve ark. 2020; Cappell ve ark. 2020) Bununla birlikte, bugüne kadar, CAR-T tedavisi, allojenik kök hücre transplantasyonu da dahil olmak üzere birkaç tedavi hattının ardından birden fazla nüksetmiş hastalığı olan hastalarda değerlendirildi ve bu yeni tedaviye hangi etkilerin doğrudan atfedilebileceğini belirlemeyi zorlaştırdı.
Nonetheless, as the use of CAR-T cell therapy increases, structured models for survivorship care will need to be established. Bakım gereksinimlerini etkileyecek faktörler arasında birincil malignite, önceki tedavi, spesifik CAR-T tedavisi ve hastanın yaşı ve kırılganlığı yer alır.
Bugüne kadar tanımlanan ana geç etkiler Tablo 36.1'de gösterilmektedir. Hipogamaglobulinemi ve uzamış sitopeni, ALL hastalarında B-NHL hastalarına göre daha yaygın görünmektedir. ALL'de tisagenlecleucel'i (Kymriah tM) test eden ELIANA çalışmasında, medyan 13 aylık takip süresinde B hücresi iyileşmesine kadar geçen medyan süreye ulaşılamadı (Maude ve ark. 2018). Her üç hücre hattında da uzun süreli sitopeniler de yaygın olarak rapor edilmiştir.
|
Tablo 36.1 CAR-T hücre tedavisinden sonraki ana geç etkiler |
||
|
Etki |
Oluşum |
Yönetmek |
|
Sitopeni (özellikle Nötropeni) Tüm dereceler |
İnfüzyondan iki ay sonra: ~50% ~20% |
Transfüzyon, büyüme faktörleri, enfeksiyon profilaksisi |
|
Hipogamaglobulinemi |
%50, infüzyondan sonra uzun yıllar |
İntravenöz immünoglobulinler (IVIG) |
|
Enfeksiyonlar |
Ağırlıklı olarak üst solunum yolu, >%50 bakteriyel |
IVIG'ler, antibiyotikler, viral tarama, aşılama |
|
İkincil maligniteler |
Solid tümör > hematolojik |
Gözetim, farkındalık |
|
Nörolojik etki |
~-10%, nöropati ve serebrovasküler olaylar |
Destekleyici bakım, tanı ve tedaviye disiplinler arası yaklaşım |
|
Psikiyatrik sorunlar |
%10, depresyon ve anksiyete Bağışıklık ile ilgili sorunlar |
|
|
Bağışıklık ile ilgili sorunlar |
< %10, alveolit, pnkümonit, dermatit, artralji ve miyozit, vb. |
Kortikosteroidler, immünosupresyon, tanı ve tedaviye disiplinler arası yaklaşım |
Bir CD28 kostimülatör alanı ile CTL109 ile tedaviden sonra yanıt veren ALL veya B-NHL'li 29 hasta üzerinde yapılan bir İsrail çalışmasında, geç sitopeni ile ilişkili faktörler önceden allo-HCT ve daha yüksek dereceli CRS idi (Fried ve ark. 2019).
ZUMA-I çalışmasında 19 ayda MDS geliştiren bir hasta dışında, üç klinik çalışmada B-ALL ve B-NHL'de CD-19'a yönelik tedavinin lisanslanmasına yol açan ikincil maligniteler rapor edilmedi. Ek olarak, bu tür ağır ön tedavi görmüş hastalarda bazı geç kanserler beklenebilir.
CAR geninin lösemik B hücrelerine istenmeden yerleştirildiğine dair rapor olmasına rağmen, şimdiye kadar CAR-Tcell üretimi sırasında insersiyonel onkogenez rapor edilmemiştir. CAR-T hücre tedavisini takiben aşıların rolü belirsizliğini koruyor. Kanıta dayalı spesifik CAR-T aşılama programları üretilmediği için HSCT'ye benzer protokoller düşünülmelidir (Majhail ve ark. 20 12).
Takip ve Programlar
Uzmanlaşmış bir hizmet olarak, Avrupa'da CAR-T tedavisi genellikle bir hub ve bağlı telefon modeline dayalı olarak sağlanır: hastalar yerel hastanelerden bölgesel hücresel terapi merkezlerine yönlendirilir. Bir seçenek, transplant alıcılarının yanı sıra JACIE tarafından akredite edilmiş allo HCT geç etki kliniklerinde takip sağlamaktır. Hayatta kalanların geç toksisiteler için sistematik ve boylamsal olarak değerlendirilmesini sağlamak için bir kontrol listesi modeli üzerinde çalışırlar. Zamanla, büyüyen hayatta kalanlar havuzunda kritik bir kitleye ulaşan özel CAR-T geç etki klinikleri geliştirilebilir. CAR-T merkezleri ve sevk merkezleri arasındaki hizmet düzeyi sözleşmesi (SLA'lar), paylaşılan bakımı ve tanıtım düzenlemeleri.
Bu tür klinikler CAR-T ile çalışmış doktorlar, uzman klinik hemşireler, klinik psikologlar, veri bilimciler ve klinik deney ekibini içeren multidisipliner (MDT) bir ekip içermelidir. Tüm CAR-T alıcıları önceden ağır bir tedavi almış olacaklardır. Bu yüzden; daha geniş ve kümülatif, fiziksel ve psikolojik sonuçlar göz önünde bulundurulmalıdır. CAR-T dayanıklılık durumunda klinik olarak işlenmesi gereken alanlar şunlardır; sekonder maligniteler, otoimmün hastalıklar; endokrinal, üreme sistemi ve kemik hastalıkları; psikolojik sağlık ve hastaların belirttiği hayat kalitesini etkileyen durumları da içeren sonuçlardır (Buitrago et al. 2019; Ruark et al 2020) Daha da önemlisi, bu zamana kadar hastalar tarafından belirtilen hayat kalitesini etkileyen durumlarda yapılan çalışmalar, fiziksel ve mental sağlığı normal popülasyonla karşılaştırılabilecek şekilde göstermektedir.
Öncelikli takip altta yatan hastalığın duruma göre karar verilir. Hastalar ilk yıl boyunca ayda bir kere görünmelidir, bu dönemde dikkat tedavinin durumu ve herhangi bir kısa süreli komplikasyonlarda olacaktır. Sonraki takip ise daha uzun süreli etkilerine odaklanabilir. 2 yıl boyunca her 6 ayda bir, 15yıl boyunca yılda bir hatta ömür boyunca bile. Daha sonra HSCT, sitotoksik terapi veya immün etkili hücre terapisi gören hastalar Majhail et al. (2012)’da tavsiye edildiği gibi takip edilmelidir
Yetkilendirme Sonrası Güvenlik Görüntülemesi (YSGG - PASS)
Tisagenlecleucel (Kymriah'™) ve axicabtagene ciloleucel (YescartaTM), otolog T-hücrelerinin viral vektörler ile genetik modifikasyonuna dayandığı için EMA ve FDA 15 yıllık bir PASS şartı ile ticari onayını verdi. 2019’da; EBMT kaynaklı hücre terapi modülünün EMA tarafından, bu tür farma-epidemiyolojik çalışmalarda kullanılmasının uygun olduğuna karar verildi. MED-A hücre terapisi formu, CAR-T hücrelerle ve diğer akademik veya endüstriyel hücre terapileriyle kullanılması için modifiye edildi. Kasım 2020’de; Alman sağlık sigorta düzenleyicisi, ticari CAR-T tedavilerinin EBMT kaydına geçirilmesini ve bu kayda geçirmenin CAR-T hücre terapi ücretlerinin düşmesi için şart olduğunu bildirdi.
JACIE
FACT-JACIE standartları öncelikle HCT programlarının akreditasyonu için geliştirilmiştir (Snowden et al. 2017; Saccardi et al. 2019). Standartların güncel yedinci versiyonu, CAR-T hücrelerini içeren immün efektör hücrelerini (IECs) de kapsamaktadır. Akut toksisitelerin yönetimindeki uygulamalara değinen maddele ek olarak, B.7.12 standardı “Hücresel terapinin geç efektlerinin uygun uzmanlar tarafından gözlenmesinin standart prosedürlerini” açıkça belirtmektedir. IEC standartlarının denetimi standart JICE saha denetimleri ile düzenlenir.
CAR-T hücre terapisini akredite olmuş allo-HCT programı dışında üstlenen merkezler için bazı seçenekler vardır.
Birçok CAR-T hücre terapisinin lenfomaların tedavisi için kullanıldığı düşünüldüğünde, IEC standartlarıyla kompliyans otolog HCT (auto-HCT)’lerin akreditasyonu ile alınabilir. Aynı önergeler myelomları allo-HCT dışında çalışan uzmanlar için de göz önünde bulundurulabilir. CAR-T hücresi içeren veya ilgili terapilerin hematolojik olmayan kanserlerde kullanılmasının daha geniş bir alana yayılması durumunda, FACT tarafından IEC akreditasyonunu CAR-T hücreleri ve diğer IEC’ler için bağımsız bir alternatif mekanizma hayata geçirildi. JACIE aynı zamanda programların EBMT kaydına zorunlu uzun-zamanlı veri girişi yapmalarından ve potansiyel hayatta kalma senaryolarından emin olmak için güçlü bir yöntem kullanıyor.
2021 yılında FACT-JACIE standartlarının 8. Baskısı, CAR-T tedavilerinin geliştirilmesi, uygulanması, yönetilmesi ve uzun süreli etkilerinin belirlenmesine yardımcı olmak için ICE’ler ile daha detaylı bilgiler içeren bir şekilde yayımlanacak.
Önemli Noktalar
ÇEVİRENLER: