
Bilinmeyen sebeplerden dolayı çoğu insanda ve farede saçın beyazlaşmasına yol açan melanosit kök hücre sistemi (McSC) diğer yetişkin kök hücre topluluklarından daha erken çöker. Şu anki görüler McSC'lerin saç folikülü nişinde farklılaşmamış bir durumda bulunduğunu ve rejeneratif uyarılara yanıt olarak uzaklaşan farklılaşmış progenitörlerden fiziksel olarak ayrıldığını göstermektedir. Biz burada, çoğu McSC'nin hem kendini yenileme hem de olgun progeni oluşturma amacıyla transit-amplifikasyon ve kök hücre durumları arasında geçiş yaptığını, bu mekanizmanın diğer kendini yenileyen sistemlerden temel olarak farklı olduğunu gösteriyoruz.
Canlı görüntüleme ve tek hücre RNA sıralaması McSC'lerin hareketli olduğunu, saç folikülü kök hücresi ve transit-amplifikasyon bölmeleri arasında yer değiştirdiğini ve yerel mikroçevresel ipuçları (örnek: WNT) tarafından yönetilen farklılaşma durumlarına geri dönüşümlü olarak girdiğini ortaya koymuştur. Uzun vadeli soy takibi, McSC sisteminin geri dönüş yapan McSC'ler tarafından korunduğunu, doğası gereği geri dönüşümlü değişikliklerden etkilenmeyen rezerv kök hücreler tarafından korunmadığını göstermiştir. Yaşlanma sırasında, melanosit progeni rejenerasyonuna katkıda bulunmayan, sıkışıp kalan McSC'lerin birikimi gözlenmiştir. Bu sonuçlar, dediferansiyasyonun homeostatik kök hücre bakımında ayrılmaz bir bileşen olduğunu ortaya koymakta ve McSC hareketliliğinin modüle edilmesinin saç beyazlamasının önlenmesi için yeni bir yaklaşım olabileceğini öne sürmektedir.
Memeli dokusunun yenilenmesi çoğunlukla yetişkin kök hücrelerinin farklılaşma kapasitesine bağlıdır. Kök hücre farklılaşması genellikle tek yönlü olarak görülür ve başlangıçta hematopoetik kök hücrelerin incelenmesiyle oluşturulan hiyerarşik modeli takip eder ⁹ ¹¹. Bu teori kök hücrelerin (farklılaşmamış durumda) iki farklı belirgin kaderi olduğunu gösterir. Biri kendilerini kendi kendine yenilenme yoluyla sürdürmek, diğeri ise doku yenilenmesi sırasında fonksiyonel farklılaşmış hücrelere dönüşen transit-amplifiye (TA) progenitörleri (ara farklılaşma durumu) üretmek için olmak üzere iki görev üstlenir ¹² ¹⁴. Bu modelde kendi kendine yenileyen dokuların ömür boyu dayanaklılığı genelde fonksiyonel ve moleküler heterojen kök hücre toplulukları ve progenitör hücreler tarafından sağlanmaktadır.
Saç pigmentasyonundan sorumlu olduğu düşünülen McSC sisteminin organizasyonunun saç folikül kök hücre (HFSC'ler) ile paralel olduğu düşünülmektedir. McSC'ler telojen fazındakı saç foliküllerinde (HF'ler) ⁴ ⁵ McSC nişini oluşturan HF epitel kök hücreleri (bulge hücreleri) ve progenitör hücrelerin (HG hücreleri) ¹⁵ ¹⁶ sardığı çıkıntı (bulge) ve saç tomurcuğu (HG'ler) bulunur. Anajen büyüme fazının başlangıcında MCsC'ler saç için üretilen pigmentlerin olduğu saç köklerine doğru giden farklılaşmış melanositleri yeniler. HG epitel hücrelerine benzer olarak HG McSC'leri WNT sinyallerini aktive eder ve yenilenmenin başlangıcında farklılaşmaya uğrar ⁷.
Üstelik, HF rejenerasyonu sırasında çıkıntıdaki (bulge) McSC'ler, saç germi (HG) bölgesindekilere göre daha yavaş döngü yapar ⁶. Bu çalışmalara göre çıkıntılardaki (bulge) McSC'lerin uzun dönemli kök hücreleri temsil ettikleri varsayılmaktadır ⁶. Buna rağmen onların hala daha belirgin fonksiyonları ve kendi kendini yenileme kapasiteleri henüz tanımlanamamıştır. HFSC'ler ve McSC'lerin yakın ilişkilerine rağmen zaman içinde dayanıklılıkları arasında farklılıklar vardır.
McSC'ler çoğu insan ve hayvanda HFSC'lere göre daha erken yorulur, bu da yaşlandıkça saçın beyazlamasına yol açar ¹ ³. Saç beyazlamasının çok yaygın olması McSC'lerin uzun dönemde olan bakımlarının spesifik dezavantajları olabileceği düşünülmektedir.
McSC sisteminin hiyerarşik yapısını daha iyi anlayabilmek için HF yenilenmesinden önceki McSC'lerin dağılımını (telojen fazı) ölçtük. McSC'ler çıkıntının (bulge) bulunduğu seviye ve azıcık daha altındaki alanlarda bulunan DCT+ melanositleri olarak tanımlandı⁴. DCT saç döngüsü sırasında tüm melanositler tarafından ifade edilen bir melanosit soy işaretleyicisidir ⁴ ⁸ ¹⁷. Önceki mikroskop analizleri ile tutarlı olarak ⁴ ⁵ DCT+ McSC'leri çıkıntılarda (bulge) ve HG'de bulunmuştur. Fakat yeni bir Dct LacZ ve DctrtTA;tetOH2B-GFP raporlama farelerinden alınan tüm telojen HF'lerin volümetrik analiz ile yapılmış 3 boyutlu görüntülemesinde çoğu HF CD34+ çıkıntısında (bulge) McSC'lerin olmadığını ortaya çıkardı. Bunun yerine çoğu McSC P-cadherin+ HG'sinde yoğunlaşmıştır (Şekil 1a ve Genişletilmiş Veri Şekil 1). HF'lerin McSC'lerin çoğunun bulunduğu nadir çıkıntıya sahip olmasına rağmen çoğu McSC HG'de bulunuyordu
(Genişletilmiş Veri Şekil 1). Buna paralel olarak, melanosit soyu da dahil olmak üzere sinir kresti kökenli hücrelerin floresan protein tdTomato ile işaretlendiği Wnt1^cre ; Rosa^LSL-tdTomato farelerinin etiketlenmesi, çoğu tdTomato+ McSC'nin HG bölgesinde yoğunlaştığını göstermiştir (Genişletilmiş Veri Şekil 1c). Bu sonuçlar saç pigmentasyonu ve McSC bakımının belki sadece HG içindeki McSC'lere sırt yaslayacağını gösterir.
HG McSC'lerinin kendi kendini yenileyebilme özelliklerine sahip olup olmadıklarını doğrulamak için telojen HG McSC'lerinin kader haritalamasını vivo görüntüleme kullanarak gerçekleştirdik. McSC'lerin genetik olarak tdTomato ile işaretlendiği ve K14+ epitel hücrelerinin HF yapısını özetleyen GFP'yi ifade ettiği bir fare modeli kullandık.
(Tyr^creER; Rosa^LSL-tdTomato; K14^rtTA; tetO^H2B-GFP mice^19–22) (Şekil 1b). Tyr^creER fareleri DCT+ McSC'leri ⁷ ⁸ ¹⁹ ²³ ²⁴ dahil olmak üzere melanositleri hedef almak üzere özelleştirildi. Klonal analiz için fareleri telojen sırasında düşük dozda tamoksifen ile tedavi ettik ve sadece bir işaretli McSC içeren HF'leri HG bölmesinde gördük. Anajen sırasında aynı saç folikülünün Yöntemler ve Genişletilmiş Veri Şekil 2a) yeniden incelenmesi, telogen fazında işaretlenen HG McSC'lerin, anajenin sonunda ölen saç soğanında olgun melanositlere dönüştüğünü göstermiştir.
ŞEKİL-1
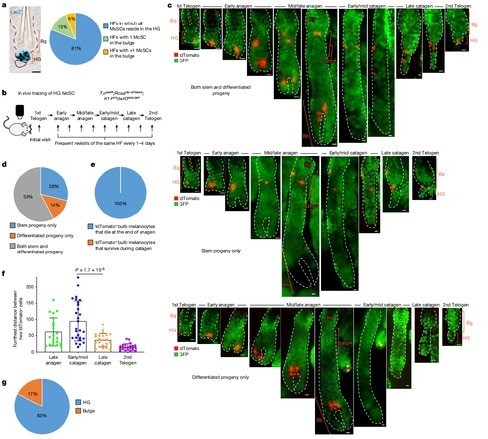
Telojen sırasında işaretlenen Melanosit Kök Hücreleri, saç kökündeki anajenin son evresinde ölen olgun melanositleri oluşturdu. (şekil 1c–e ve Detaylı bilgi Fig. 2b) Ayrıca işaretlenen Kök hücrelerinin anajen sırasında bulge(çıkıntı) bölgesi ve dış kök kılıf bölgesi (bulge/DKK) nişine göç ettiği ve kalıcı olmalarını sağlayan kendini yenileme kapasitesi gösterdiği tespit edildi. (şekil 1c,d ve Detaylı Bilgi şekil 2b). Geç katagen sırasında çoğu bulge/DKK nişindeki kıl folikülünün alt kısmında toplanmıştı. (şekil 1f, Detaylı bilgi şekil 3). Sıradaki telojen evresinde çoğu HG kompartmanına geri döndüler. (şekil 1c,g Detaylı bilgi. 2b ). Bu sonuçlar şunu gösterdi ki HG epitel hücreleri çoğalma ve farklılaşma sonrası yok oluyor. Kıl folikülü kök hücre sisteminin aksine, HG de bulunan melanositler ise kendini yenileme özelliğini saklı tutuyor.
Önceki çalışmalar şunu gösterdi ki saç folikülü yenilenme indüksiyonunun ardından HG'deki WNT proteinleri epitel hücrelerinin ve melanositlerin farklılaşmasını sağladı. Daha sonra epitel hücreleri TA(transit-amplifying) hücreler gibi davrandı ve kendini yenileme özelliğini korumadan çoğaldı ve farklılaştı. Melanosit hücrelerinin nasıl bu kadar pro farklılaşma ortamında toplanmışken kök hücre özelliklerini korudukları araştırmak için, HG'deki Melanosit Kök Hücrelerinin farklılaşma durumunu inceledik.
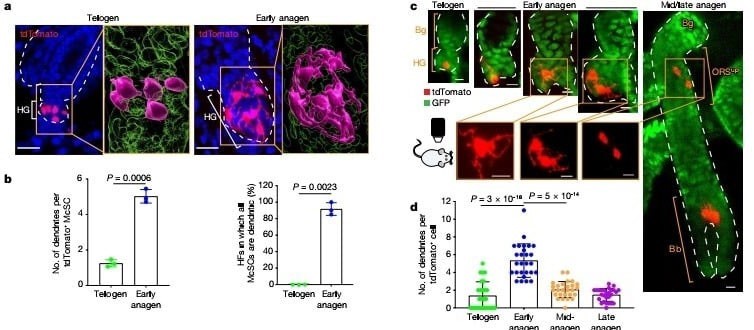
Sessiz telojen evresinde melanosit kök hücreleri,farklılaşmamış melanositlerin kompakt oval ya da bipolar şeklini gösterdi. Ancak HG kompartmanında TA hücreleri oluştuğunda, önemli değişimler gösterdiler, HG'deki tüm melanositler farklılaşmış melanositleri andıran dentritik bir görüntü sergiledi. (Şekil 2a,b) İncelenen saç foliküllerinin %90'ından fazlasında tüm melanositler bu evrede dentritik morfoloji sergiledi. (Şekil 2b) Canlı görüntüleme şunu gösterdi ki HG'deki Melanosit Kök Hücrelerinin çoğunluğu ilk bölünmelerinden önce niş içinde dentritik bir morfolojiye geçti. (Şekil 2c Detaylı bilgi şekil 4). Yavru hücreler de ayrıca dentritikti bu da morfolojik değişimlerin melanosit kök hücre aktivasyonunda erken bir evreyi temsil ettiğini gösteriyor. (Şekil 2c Detaylı bilgi. 4). Bu morfolojik değişim geçiciydi ve melanosit kök hücreler HG'den bulge/DKK'ye göç ettikten sonra dentritlerini geri çekti. (Şekil 2c,d)
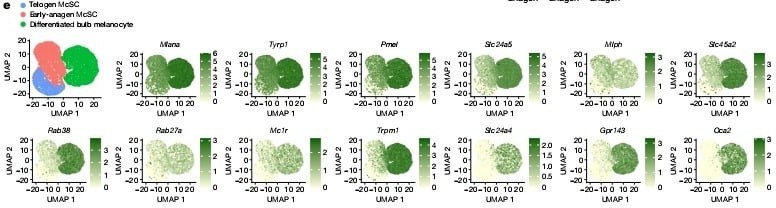
Telojen ve erken anajen melanosit kök hücrelerinin karşılaştırmalı tek-hücre RNA sıralama çalışmaları ve bulb melanositlerinin floresan ile aktive edilmiş hücre sıralama çalışmaları melanositlerin dentrit oluşumunda görev alan genlerini onayladı, mesela Rac1 geni saç foliküllerinin olgun melanositlerinde görülene benzer bir şekilde ifadesini arttırmıştı. (Detaylı bilgi şekil 5a–c). Biyolojideki " Daha az özelleşmiş bir hücrenin, soy hattının işlevini yerine getirmek üzere olgunlaşması süreci" farklılaşma tanımını baz alarak pigmentasyon genlerini güvenilir bir farklılaşma işareti olarak değerlendirdik. FeaturePlot analizleri çoğu erken anajen evresinde tespit edilen ama telojen melanosit kök hücrelerinde görülmeyen bir sürü pigmentasyon geni gösterdi. (Şekil 2e) Ek olarak çoğalan ve çoğalmayan erken anajen melanosit kök hücreleri benzer imzalar gösterdi bu da bize farklılaşmanın çoğalma durumundan bağımsız olabileceğini gösterdi (Detaylı bilgi şekil 5d,e). Bununla birlikte, telojen ve erken anajen HG melanosit kök hücreleri tarafından ifade edilen belirli bir gen seti vardı, ancak bu genlerin bulb melanositlerindeki ifadesi azaldı. Bu genlerini bazılarının yenilenme ve hayata kalma fonksiyonu ile ilgili potansiyel kök hücre özelliği vardır. Pseudotime analizi gösterdi ki erken anajen melanosit kök hücreleri telojen melanosit kök hücreleri ve bulb melanositleri arasında bulunuyor. (Detaylı bilgi şekil 5h)
Bu analizleri baz alarak şöyle bir hipotez öne sürdük.Yenileyici uyarıların işaretlerini takiben büyüyen HG'de, tüm popülasyon seviyesinde melanosit kök hücreleri ortalama bir farklılaşma evresine( TA benzeri) farklılaşabilir ve melanosit kök hücrelerinin devamı onların dediferensiyasyonuna bağlı olabilir.
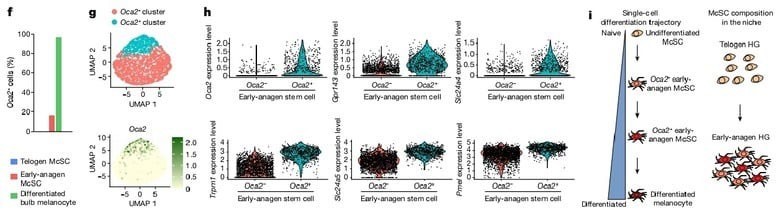
Bu hipotezi test etmek için çoğu farklılaşmıs HG melanosit kök hücre grubunun kaderini inceledik. tek-hücre RNA sıralama çalışmamıza göre tüm olgun bulb melanositlerinde ifade edilen ama sessiz telojen melanosit kök hücrelerinde ifade edilmeyen bir geç pigmentasyon genine odaklandık, Oca2.(şekil 2e,f) Dikkate değer bir şekilde, erken anajen McSC'lerin küçük bir alt grubu da Oca2 ifade etti.Erken anajen kıl foliküllerinde Oca2+ McSC'lerin, Oca2– McSC'lere göre daha farklılaşmış olduğunu doğrulamak için, hücre döngüsü genlerini çıkararak Oca2+ hücrelerinin diğer erken anajen McSC'lerden ayrıldığı scRNA-seq verilerini yeniden analiz ettik. Analizler şunu gösterdi ki farklılaşma markerları(pigmentasyon genleri) Oca2+ hücrelerde Oca2- hücrelere göre daha çok ifade edildi. Oca2+ bulb melanositlerinin aksine Oca2+ erken anagen melanosit kök hücreleri telojen ve diğer erken anajen melanosit kök hücreleri tarafından ifade edilen genlerin ifadesini korudu. (Detaylı bilgi şekil 6). Bu sonuçlar şunu gösteriyor erken anajen evresindeki çoğu HG melanositleri pigmentasyon genlerinin fazla ifadesini başlatırken en farklılaşmış olanlar ayrıca Oca2 ifade ediyor.
Daha sonra genetik olarak Oca2+ HG melanosit kök hücre kaderini gözlemlemek için Oca2 creER ;Rosa LSL-tdTomato reporter fareleri oluşturduk.(Detaylı bilgi şekil 7a). Tamoksifen enjeksiyonu almayan farelerde hiç tdTomato+ hücre gözlenmedi. (Detaylı bilgi şekil 7b) Bu yeni aracı kullanarak, anajen başlangıcından itibaren McSC'lerin kaderini izledik. Oca2 creE
;RosaLSL-tdTomato farelerini, erken anajen sırasında 3 gün boyunca günde bir kez tamoksifen ile enjekte ettik. Bu işlem başarılı bir şekilde dentritik morfoloji gösteren, Oca2 mRNA ifade eden ve HG'de bulunan Oca2+ melanosit kök hücrelerini işaretledi. (Şekil 3a Detaylı bilgi Fig. 7d,e) Oca2+ hücreler, çoğalan ve çoğalmayan melanosit kök hücrelerini içermekteydi; bu sonuçlar, tek-hücre RNA sıralama çalışma verilerimizle tutarlıdır.(Detaylı bilgi şekil 5d,e)
HG anajen bulb tamamen oluştuğunda Oca2+ işaretlenen hücreler hem farklılaşmış melanositlere hem de anajen bulb/DKK melanosit kök hücrelerine katkı sağladı (şekil 3a Detaylı bilgi Fig. 7g,h). Orta-geç anajen evresine kadar bulge/DKK nişindeki tdTomato+ hücreler Oca2- evreye geçti ve Gpr143 gibi diğer farklılaşma markerları (pigmentasyon genleri) ifadesini de azalttı (Detaylı bilgi şekil 7i)
Sonraki telojen fazına kadar, çoğu tdTomato+ hücre HG'ye yerleşti (Detaylı bilgi. 7j) ve farklılaşmamış durumlarını yeniden kazandı. (şekil 3a) Bu tdTomato+ melanosit kök hücreleri en az 2 yıl boyunca bulb melanositlerini yenileme yeteneğini korudu ( İncelenen son nokta; şekil3b,c) bizim tek-hücre RNA sıralama çalışmamız ile tutarlı olarak dediferensiyasyona uğrayacak HG Oca2+ hücreler kök hücre genlerini geri kazandılar. ( örnegin Col12a1, Txnip and Cdh1( E-kaderin kodlar) ama bulbda olgunluğun son evresine geçen hücreler bu genleri kaybettiler(Detaylı bilgi şekil7i).
Geç anajen Oca2+ bulb melanositlerine dönüşen hücrelerin soy izlemesi canlı görüntüleme sonuçlarını doğruladı, bulb melanositleri kalıcı değiller. (Detaylı bilgi şekil 8). Bu sonuçlar HG deki farklılaşmış Oca2+ melanosit kök hücrelerinin farklılaşmamış melanosit kök hücrelere dediferensiye olabileceğini ama olgun bulb melanositlerinin dediferensiye olamayacağını gösteriyor.
Önceki çalışmalar, melanosit kök hücre TA hücrelerinin c-Kit'e bağımlı olduğunu ve c-Kit nötralize edici antikor enjeksiyonu sonrası ortadan kaldırılabildiklerini göstermişti. Oca2+ hücrelerinin c-Kit'e bağımlı olup olmadığını belirlemek için, farelere c-Kit nötralize edici antikor enjekte ettik. Bu, tdTomato+ hücrelerin neredeyse tamamen ortadan kalkmasına neden oldu. (Şekil 3d) Bu da erken anajen sırasında ortaya çıkan TA hücrelerinin Oca2+ melanosit kök hücreleri içerdiğini gösteriyor.Mevcut teoriler, bu tür TA hücrelerinin erken anagen sırasında HG'nin alt kısmında uzaysal olarak ayrıldığını belirtmektedir.Bu alandaki Oca2+ McSC'lerinin hala bir kök hücre durumuna geri dönebilip dönemediklerini doğrulamak için in vivo canlı görüntüleme tekniği kullandık. Büyüyen HG ve bulb bölgesinin en alt bölgesinde bulunan genetik olarak işaretlenen tek Oca2+ kök hücre bulunduran saç foliküllerini bulduk. (anajen II/IIIa sac folikülü Oca2creER;RosaLSL-tdTomato;K14rtTA; tetOH2B-GFP farede)
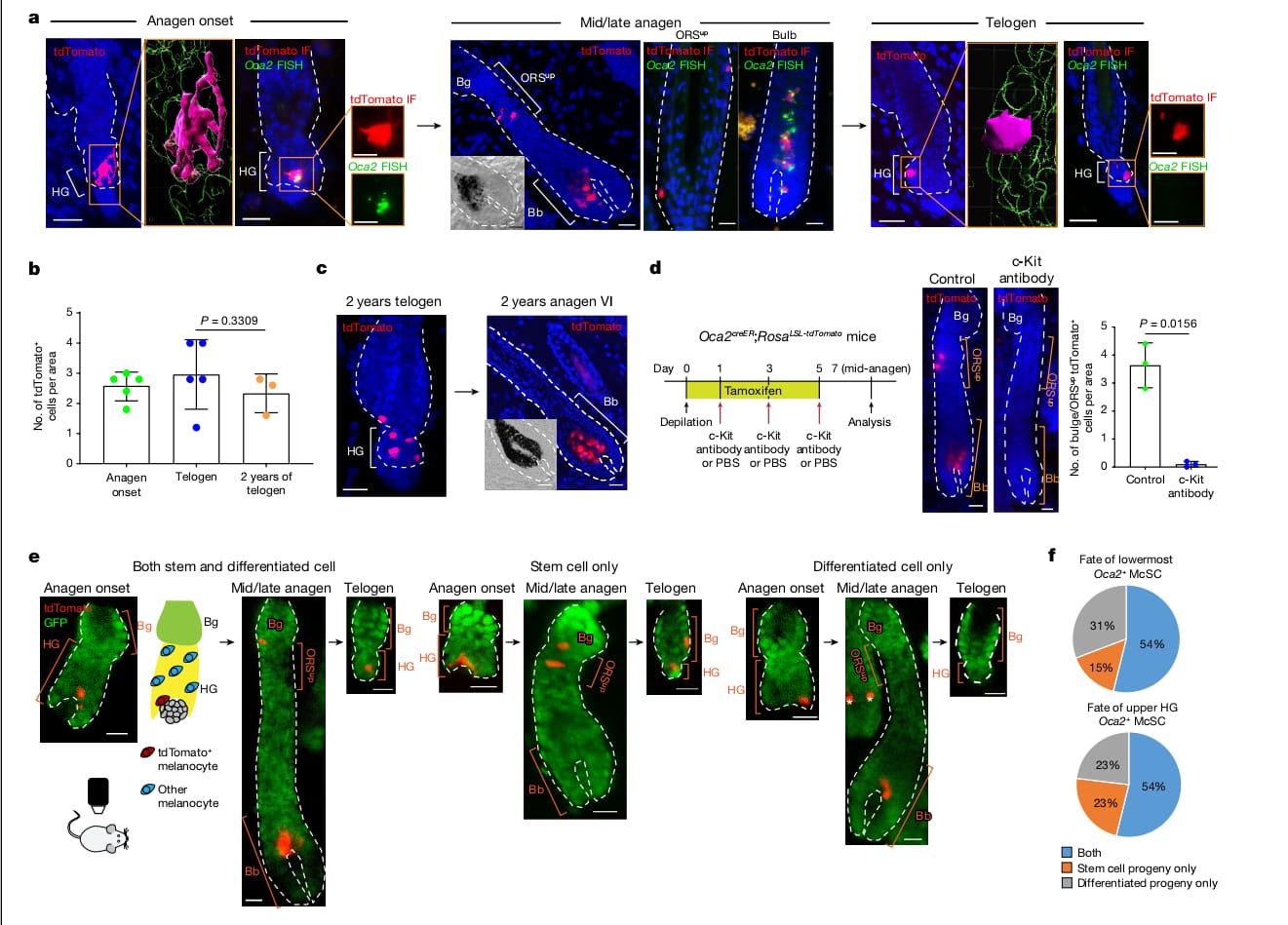
HG’nin aşağı tarafındaki Oca2+ McSC’ler bulge/ORSup ‘a doğru, HF’nin kök hücre bölümüdür ve üst HG Oca2+ McSC(Şek. 3e,f)’ye benzer şekilde bir sonraki telojen tarafından yerleri HG’ye taşınır, yer değiştirebildiler. Alternatif olarak, HF’nin küçülmesiyle birlikte azalarak ampulde tamamen farklılaşmış melanositlere gelişebilir (Şek. 3e,f). Bu sonuçlar, büyüyen HG’nin en altındaki, TA bölümü olarak da bilinir, son aşamadaki Oca2+ McSC’ler uzun süre daha dediferensiyona ve varlıklarını sürdürmeye devam edebilir.
Tüm McSC'ler erken anajen fazında Oca2'yi ifade etmediğinden, Oca2+ alt kümesinin saç folikülünde sabit bir alt popülasyon oluşturup oluşturmadığını veya diğer McSC'lerin de sonraki bir anagen fazında Oca2 ifade edip edemeyeceğini sorguladık. Sağ, resimler (N=3) ve tdTomato’nun miktarı. Her fare için 10 alan analiz edildi. P değeri, çift yönlü bağımsız t-testiyle belirlendi. e, Oca2creER;RosaLSL-tdTomato;K14rtTA;tetOH2B-GFP farelerinde tek bir tdTomato⁺ hücrenin canlı soyağacı izlenmesi, üç farklı kader ortaya koyar. GFP, K14+ epitelyal hücrelerini işaretler. Resim, HF’deki tdTomato melanositleri ve diğer melanositlerin bağıl konumunu gösterir. Beyaz yıldızlar bağımsız HF’deki tdTomato+ hücrelerini işaretler. f, HG’nin alt bölgesinde (1 fareden alınan N =13 HFler) ve üst bölgesinde (1 fareden alınan N=13 HF’ler) yalnız bulunan Oca2+ hücrelerinin belirtilen soyları oluşturma yüzdeleri. A ve c’deki orta/geç anajen resimlerindeki küçük eklentiler bulb parlak alan görüntülerini göstermektedir. b ve d için veriler, ortalama ± standart sapma şeklinde sunulmuştur. Ölçek çubukları, 20 µm ya da 10 µm’dir.
Kesikli beyaz çizgiler epitelyal-dermal sınırı gösterir (a,c,d,e).
HF veya diğer McSC’ler ilerleyen anajen fazlarında Oca2 eksprese edebilir. Bu teoriyi test etmek için art arda HF rejenerasyonunu indükledik ve her anajen başlangıcında Oca2+ McSCleri tamoksifen tedavisiyle etiketledik (Genişletilmiş Veri Şek. 9a). tdTomato hücreleri içeren HF’lerin yüzdesinde ve HF başına düşen tdTomato+ McSC sayılarında kademeli artışlar gözlemledik (Genişletilmiş Veri Şek. 9b-e). Bu sonuç, Oca2+ McSC’lerin yalnızca bir kez etiketlendiği kontrol deneylerinde farklılık gösterdi. Bu sonuçlar, yeni (etiketlenmemiş) McSC’lerin farklı anajen başlangıçlarında Oca2 eksprese edebileceğini (scRNA-seq analizine göre her bir saç döngüsünde yaklaşık %20) ve her iki kadere de (farklılaşma ve yenilenme) katkı sağlayabileceğini gösterdi. Tekrarlı tamoksifen enjeksiyonundan olşan üç döngü sonrasında, yalnızca tdTomato+ McSC’lerin yerleştiği HF nişleri (>20% HF analiz edildi.) gözlemlendi ve bu da farklı McSC’lerin farklı saç döngülerinde Oca2 ekprese edebileceğini gösterdi.
Bu sonuçlar, doğuştan Oca2+ TA benzeri bir durumu yaşamaktan muaf olan herhangi bir kök hücre topluluğunun olmadığını önermektedir (Genişletilmiş Veri Şek. 9g).
Derinin, sürekli olarak melanosit farklılaşmasını37,38 artıracak çevresel faktörlere maruz kaldığını göz önünde bulundurduğumuzda McSC’lerin de bu koşullarda farklılaşıp farklılaşamayacağını sorduk. Bunun için Oca2creER; RosaLSL-tdTomato farelerini UVB ışınına maruz bıraktık ve Oca2+ hücrelerini tdTomato raporlayıcıyla etiketlemek için farelere tamoksifen enjekte ettik (Genişletilmiş Veri Şek. 10a). Tedaviden iki gün sonra, tdTomato+ McSC’ler kök hücre nişinde bol miktarda pigment üretti (Genişletilmiş Veri Şek. 10b,c). UBV’ye maruz bırakılan McSC’ler gelişti (Genişletilmiş Veri Şek. 10b,c) ve bulb melanositlerine göre daha az ölçüde de olsa orta anajen bulge/ORSup ‘da farklılaşma belirtileri gösterdi (Genişletilmiş Veri Şek. 10d). Bu sonuçlar, UVB ışınına maruz bırakılmanın McSC’lerin fonksiyonel melanositlere daha hızlı farklılaşmasına sebep olduğunu öne sürmektedir. Geç anajende bulge/ORSup ‘da bulunan tdTomato+ McSC’ler; Tyrp1, Oca2 ve Gpr143 farklılaşma belirteçlerinin eksprasyonlarını önemli ölçüde azalttı ve bu durum onların farklılaşma sürecinde olduğunu gösterdi (Genişletilmiş Veri Şek. 10d,e). Bir sonraki telojen fazında tdTomato+ McSC’ler yine HG’ye geri döndüler.
Farklılaşma belirteçleri ve pigmentasyonun azaltılmasıyla belirtildiği üzere farklılaşmamış bir fenotip elde ettiler (Genişletilmiş Veri Şek. 10g). UVB ışınına maruz bırakılmalarından iki yıl sonra, HG’de benzer sayılarda tdTomato⁺ McSC gözlendi ve pigment bulunamadı (Genişletilmiş Veri Şek. 10g). tdTomato+ McSC’ler epilasyonla indüklenmiş HF rejenerasyonundan sonra da kıl pigmentasyonu yapabilen ampul MC’ler oluşturma yeteneğini korudu (Genişletilmiş Veri Şek.
10h). Tedavi edilmemiş Oca2⁺ McSC’lerde gözlemlendiği gibi (Genişletilmiş Veri Şek. 7i), UBV ile tedavi edilmiş ve farklılaşmaya tasarlanmış Oca2⁺ McSC'ler kök hücrelere özgü genlerin (örneğin; Col12a1, Txnip ve E-kadherin) ekpresyonunu yapmayo sürdürdü (Genişletilmiş Veri Şek. 10i). Bu sonuçlar; UVB ışınlanmasından sonra asıl farklılaşma fonksiyonları olan görünür pigment üretmeye yönlendirilmiş McSC’lerin de farklılaşmamış bir duruma geri dönebileceğini gösterir niteliktedir.
Sonrasında, McSC’lerin farklılaşmasını mümküm kılan mekanizmaları araştırdık. Önceki araştırmalar, McSC’lerdeki WNT’lerin sürekli aktif hale gelmesinin, bu hücrelerin zamansız bir şekilde farklılaşmasına ve sonunda kaybına yol açtığını; WNT inhibisyonunun ise melanosit rejenerasyonunu azalttığını göstermiştir7,39,40. Anajen başlangıcında McSC farklılaşmasını artırmak için WNT ligandları HG’de yukarı regüle edilir. HG hücreleri HF bulb oluşturmak için aşağı doğru büyüdükçe WNT aktif alanı da anajen fazı boyunca aşağı hareket eder (Genişletilmiş Veri Şek. 11a). Buna rağmen canlı görüntülemelerimiz, WNT sinyallerinin baskılandığı bilinen anajen bulge/ORSup ‘a yerleşebileceğini gösterdi. Bulge/ORSup ‘a olan göçü takiben WNT ligandlarının aşağı regüle edilmesinin McSC’lerin yeniden farklılaşabilmesini mümkün kılacağını öne sürdük.
İlk olarak, WNT’nin farklılaşma durumuyla nasıl doğru orantılı olduğunu anlamak adına scRNA- seq verilerini inceledik. Bu analiz WNT aktivasyon genlerinin erken anajende, özellikle son evredeki Oca2⁺ McSC'ler, yukarı regüle edildiklerini gösterdi (Genişletilmiş Veri Şek. 11b,c).
İmmünofloresan verileri Oca2⁺ McSC'lerin anajen başlangıcındaki HG'de WNT sinyalini aktive ettiğini doğruladı (Genişletilmiş Veri Şek. 11d-f). Ayrıca, WNT sinyalleri bulge/ORSup ‘da orta-geç anajen sırasında UVB ışınlamasından bağımsız olarak aşağı regüle edildi.
İkinci olarak, anajen Oca2⁺ McSC'lerde kalıcı WNT aktivasyonunun, bu hücrelerin farklılaşmamış bir McSC durumuna geri dönüşünü engelleyip engellemediğini doğruladık. Oca2⁺ McSC'lerde (Oca2creER ; Ctnnb1STA; RosaLSL-tdTomato farelerinden43) stabilize edilmiş β-katenin (Ctnnb1 tarafından kodlanmış) eksprese edilerek WNT sinyalinin sürekli olarak aktive edilmesi, bu koşullar altında bu hücrelerin hayatta kalıp anajen bulge/ORSup’a yerleşmesinden sonra pigment eksprese edebilmek için anormal bir şekilde farklılaşmaya devam ettiğini gösterdi (Genişletilmiş Veri Şek. 12a,b). Buna karşılık, normal Oca2⁺ hücreler farklılaşmamış bir duruma geri döndü (Genişletilmiş Veri Şek. 12a,b). Bu nedenle, WNT aktivitesinin aşağı regüle edilmesi, Oca2⁺ McSC'lerin yeniden farklılaşmasını sağlar. Uzun dönemde incelendiğinde, β-katenin stabilize edilmiş farelerdeki tdTomato+ McSC’ler belirgin bir azalma gösterdi (Genişletilmiş Veri Şek. 12c). Bu sonuç uzun süreli WNT aktivasyonunun McSC’leri tükettiğini gösteren önceki çalışmalarla tutarlılık gösterir.
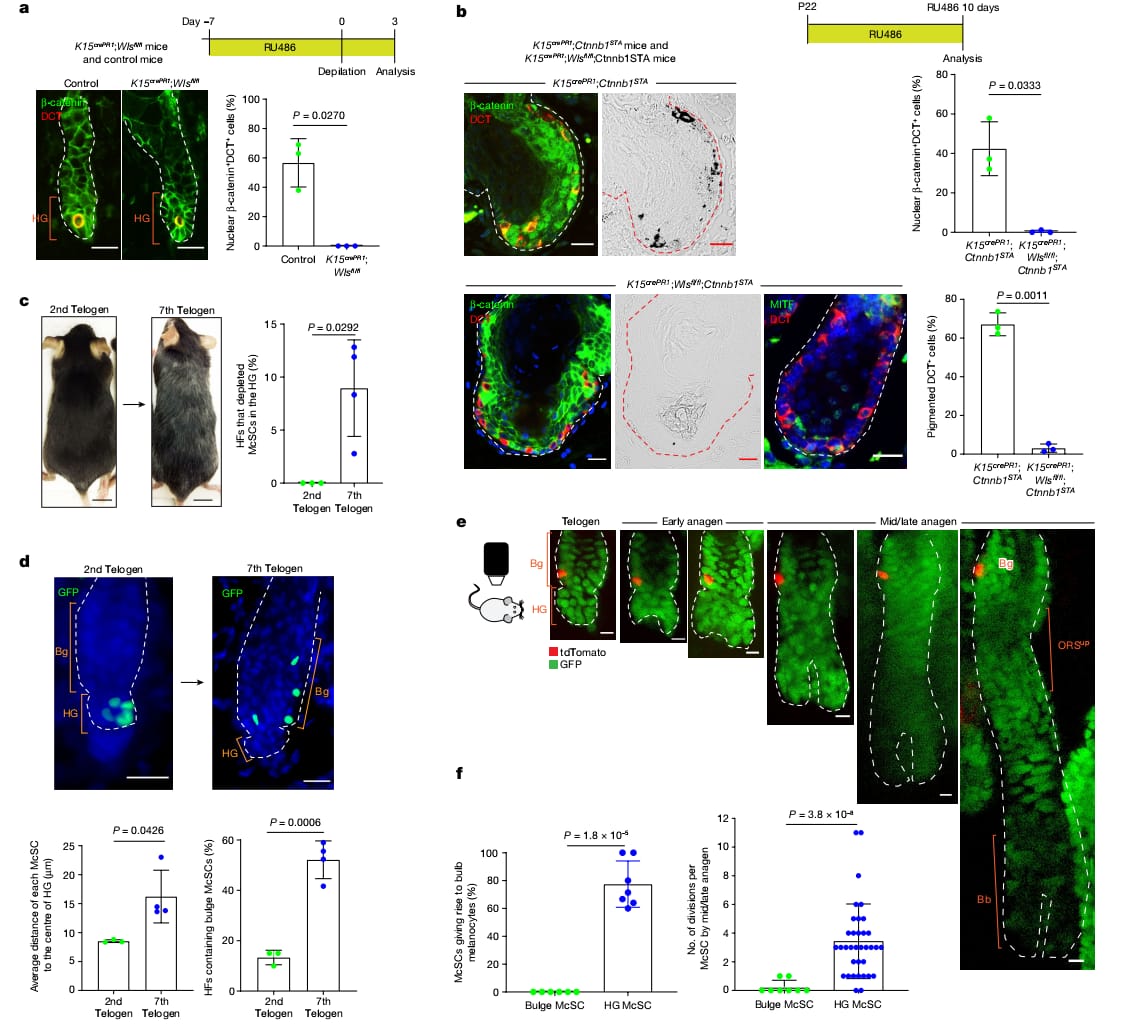
Son olarak, WNT aktifliğinin epitelyal niş hücreleri tarafından düzenlenip düzenlenmediğini doğrulamak için, Wntless’i (Wls) indüklenebilir bir şekilde silmek ve özellikle çıkıntıdaki ve HG’deki McSC’leri saran K15+ epitelyal hücrelerinden WNT ligand salınımını önlemek için K15crePR1 ;Wlsfl/fl farelerini kullandık. RU486 ile yapılan indüksiyondan ve peşine anajen başlangıcından sonra bu farelerde McSC'lerde ve çevresindeki epitelyal hücrelerde nükleer β- katenin ekspresyonunda bozukluklar gözlemlendi (Şek. 4a). Bu sonuç, epitelyal türevli WNT ligandlarının McSC WNT aktivasyonunda önemli bir rol oynadığını gösterdi. WNT aktivitesinde yalnızca McSC’lerin bozulduğundan emin olmak için RU486’yla tedavi edilmiş K15crePR1; Wlsfl/fl;Ctnnb1STA fare43 ‘lerdeki , burada Wls silinmiş ancak , McSC’leri β-catenin sinyali epitelyal hücrelerinde korunmaktadır, McSC’yi inceledik. Daha önce yayımlanan sonuçlar ve Şekil 4b, kontrol RU486 ile tedavi edilen K15crePR1;Ctnnb1STA saç folikülü kök hücrelerinde (HFSC) sürekli WNT aktivasyonunun, anormal ancak pigmentli saç folikülü gelişimine neden olduğunu göstermektedir.Daha önce yayımlanan sonuçlar ve Şekil 4b, kontrol RU486 ile tedavi edilen K15crePR1;Ctnnb1STA saç folikülü kök hücrelerinde (HFSC) sürekli WNT aktivasyonunun, anormal ancak pigmentli saç folikülü gelişimine neden olduğunu göstermektedir.Wls geni eksik farelerde bununla birlikte, Wls geni eksik farelerde, epitelyal niş hücreleri WNT ligandlarını salgılayamamalarına rağmen WNT aktivasyonu ve nükleer β-katenin lokalizasyonu gösterdi (Şekil 4b). Buna karşılık, DCT⁺ melanositler nükleer β-katenin sergilemedi, melanosit farklılaşma belirteci olan MITF'i göstermedi veya pigment üretmedi (Şekil 4b). Sonuç olarak, bu bulgular niş türevli WNT ligandlarının McSC'lerin geri dönüşümlü farklılaşmasını düzenlediğini göstermektedir.
Yukarıdaki sonuçlar McSC’lerin kök hücre (WNT– bulge/ORSup) ve HF’nin TA (WNT+ HG/bulb) bölmeleri arasında yer değiştirebilme yeteneğinin, farklı farklılaşma durumlarına geri dönüşümlü olarak ulaşabileceğini göstermektedir. Ancak, yaptığımız canlı görüntülemeler HG’den çıkan bütün McSC’lerin bir sonraki telojen fazında HG’ye geri dönmeyeceğini, bunun yerine telojen bulge’de kalacağını göstermiştir (Şekil 1c,g ve 3e ve Genişletilmiş Veri Şekil 7j). İnsanlarda ve farelerdeki saç beyazlamasının yaygınlığının yüksek olduğu göz önüne alındığında, HG McSClerinin dağılımdaki bu değişimin yaşlanmaya bağlı olup olmadığını araştırdık.
Bu amaçla, HF’lerin yaşlanmasını DctLacZ farelerinde ve DctrtTA;tetOH2B-GFP farelerinde postnatal gün 21 itibariyle (P21) her teloejen fazının başlangıcında tekrarlayan epilasyon uygulayarak deneysel olarak hızlandırdık17,18,47. Daha önceki çalışmalara paralel olarak, yedinci telojen fazda HG'de oldukça fazla McSC kaybı görülen HF'ler tespit ettik (Şekil 4c). Beklendiği üzere, bu farelerin kıllarının beyazladığı görüldü (Şekil 4c).
Bunun yanında, yaşlanmış HF’lerdeki McSC’ler konumlarını değiştirdi ve HG bölmesi içinde sıkı bir şekilde toplanmak yerine bulge bölgesine dağıldı (Şekil 4d ve Genişletilmiş Veri Şekil 13a,b). Görüntü analizleri yaşlı HF’lerde tek başına bulunan McSC’lerin arasındaki uzaklığın genç HF’lerdekine göre çok daha fazla olduğunu ortaya çıkardı (Şekil 4d). Bulge McSC içeren HF’lerin yüzdesi 10%’dan 50%’nin üzerine çıktı. Buna benzer bir gözlem, tekrarlayan yolma sonrasında (≥6 saç döngüsü boyunca) Oca2creER;RosaLSL-tdTomato farelerini incelediğimizde de ortaya çıkmıştı (Genişletilmiş Veri Şek. 13c-e).
Bu tür anormal McSC dağılımının olgun melanositlerin rejenerasyonunu etkileyip etkileyemeyeceğini anlamak için, genç telojen hf'lerdeki nadir çıkıntı mcsc'lerini canlı görüntüleme yoluyla spesifik olarak izlendi ve farklılaşmış melanositler üretme yeteneklerini değerlendirildi. Telojen çıkıntı Ncsc'leri, farklılaşmış melanosit bölmesine katkıda bulunmadan yalnızca çıkıntı veya Sup McSC yavrularına yol açtı (Şekil 4e, f). Dahası, çıkıntı yapan mcsc'ler ya hareketsiz kaldı ya da McSC yavrularına yol açmak için sınırlı bölünmeye tabi tutuldu (Şekil 4e, f). Bu, hem kök hücrede hem de farklılaşmış hücre bölmelerinde yavruları yenilemek için aktif olarak çoğalan HG mcsc'lerin aksineydi (Şekil 1c, d ve 4f). Bu sonuçlar, ampul melanosit rejenerasyonuna doğrudan katkıda bulunmayan telojen çıkıntı yapan mcsc'lerin, tekrarlayan saç rejenerasyonunun neden olduğu HF yaşlanması sırasında arttığını ortaya koymaktadır.
Tartışma
Toplu olarak, verilerimiz McSC sisteminin, HG mcsc'lerin rejenerasyonun başlangıcında hem kök hücreler hem de TA hücreleri olarak işlev gördüğü ince katmanlı bir sistem olduğunu göstermektedir. Bulgular, farklılaşmanın homeostatik kök hücre bakımında ayrılmaz bir rol oynadığı yeni bir modeli ortaya koymaktadır (Genişletilmiş Veriler Şek. 11f). Bu yeni McSC bakım modeli, daha önce bilinmeyen bir plastisite seviyesini vurgulamaktadır. Ayrıca, bu sistemin savunmasızlığını, ayrı işlevlere ve konumlara sahip çok katmanlı farklı kök hücre ve progenitör hücre popülasyonları aracılığıyla çalışan diğer kök hücre sistemlerinin çoğuna kıyasla belirlendi. Mcsc'lerin bukalemun benzeri özelliklerini göstermek için hareketli olmaları gerekir, böylece hf'nin TA bölmesinde (büyüyen HG alanı) bulunduklarında bir TA fenotipi ve ardından bir kez hf'nin kök hücre bölmesine nakledildiğinde bir kök hücre fenotipi gösterirler (Genişletilmiş Veriler Şek. 11f). Bu nedenle, doku rejenerasyonu sırasındaki HFSC ve McSC organizasyonu, kök hücre ve TA hücreleri farklılaşma fenotipleriyle tanımlandığında paralel görünebilir. Bu iki kök hücre sistemi arasındaki en önemli fark, farklılaşma durumu ve konumu açısından TA fenotipini sergileyen mcsc'lerin geriye doğru hareket edebilmesi ve farklılaşarak kök hücrelere dönüşebilmesidir. Bununla birlikte, kök hücre ve TA bölmeleri arasındaki McSC hareketinin, tekrarlanan rejenerasyonlar sırasında tam olarak yeniden özetlenmediğini ve HF yaşlanması sırasında bu harekete geçemeyen mcsc'lerin birikmesine neden olduğunu da gösterildi
Önceki çalışmalar, niş içindeki bireysel yetişkin kök hücrelerin konumlarının HFSC ve bağırsak sistemlerinde sabitlenmediğini veya değiştirilebileceğini göstermiştir (12,26,48). Mcsc'ler saç melanositlerini yalnızca HG bölmesi içindeyken yeniden oluşturduklarından, saçların grileşmesini önlemek için uygun lokalizasyonları gerekecektir. Mevcut teori, mcsc'lerin yaşlanma sırasında genotoksik hasar biriktirdiğini ve anajen niş sinyallerine yanıt olarak terminal farklılaşması yoluyla zaman içinde kademeli olarak ortadan kaldırıldığını öne sürmektedir (49).
Bu nedenle, farklılaşma yanlısı sinyallerin HG bölümünde yoğunlaşması muhtemeldir (7) ve çıkıntı mcsc'ler, var olduklarında, bu tür farklılaşma uyaranlarına daha az maruz kalma nedeniyle daha yüksek bir hayatta kalma oranına sahip olabilirler. Olağanüstü koşullar altında, çıkıntı yapan mcsc'ler saçın yeniden pigmentasyonu için geçerli bir melanosit üretim kaynağı görevi görebilir, ancak bunun için hg'ye daha yakın bir yer değiştirme ön koşul olacaktır.
Son olarak, melanositlerden (melanomlar) türetilen tümörler, epitelyal kanserler de dahil olmak üzere diğer birçok tümörün aksine, tamamen farklılaşmış, pigmentli fenotipleri 50,51'den bağımsız olarak kendi kendini yenileme yeteneklerini korurlar. Bu farklılık nedeniyle melanomların ortadan kaldırılması zordur ve cilt kanserinin en tehlikeli formunu temsil eder. Bu çalışma, fizyolojik koşullar altında normal mcsc'lerin plastisitesine dair kanıt sağlamıştır. Bu bulgunun bir sonucu, normal melanositlerin farklılaşmadan sonra kendini yenileme yeteneğini koruma konusundaki bu belirgin kapasitesinin, melanomun plastik doğasının en azından kısmen altında kalabileceğidir.