Kanserin sebep olduğu ölümlerin başını akciğer kanseri çeker. Tedavide başarısızlık, kanserin tekrar nüksetmesi ve yalnızca kanser kök hücrelerinin (CSCs) varlığıyla tetiklenen yayılım; ölümle sonuçlanan bu akciğer kanserlerinin karakteristik özelliklerindendir. Bu kanser türü üzerine yapılan çevrimsel (translasyonel) ve moleküler araştırmalar, akciğer kanser biyolojisi ve çeşitli tedavi yaklaşımları üzerine özgün verileri ve kapsamlı raporları gözler önüne sermektedir. Spesifik akciğer CSCs belirteçlerinin üzerinde yapılan detaylı incelemelerin yardımıyla hedeflenen akciğer CSCs, klinik sonuçlarını uzun vadede iyileştirebileceğine ve akciğer kanserini bir daha tekrar etmemek üzere ortadan kaldırabileceğine dair umutların yeşermesine ortam hazırlamıştır.
Prostat kanseri (PCa), Dünya çapındaki erkeklerde görülen en yaygın kanser türü olmakla birlikte erkeklerin en temel ölüm sebebidir. Bu heterojenik durum, genom ve mekanizmaların kararsızlığı sonucu epigenetik vasıtasıyla hücresel farklılaşmanın ortaya çıkmasına dayandırılır. Geçtiğimiz on yıl içerisinde, PCa kök hücrelerinin (PCSCs) PCa üzerindeki hayati önemi kanıtlarıyla gün yüzüne çıkarılmıştır.
Bu kanser tiplerindeki metastaz ise ikinci nesil ilaçların hayatta kalma avantajlarının kısıtlı olması yüzünden, hastalarda da gözlemlendiği üzere, bu zamana kadar aşılması güç bir engel olarak varlığını sürdüregelmiştir. Moleküler mekanizmalar ortaya koymuştur ki tümör baskılanmasındaki mutasyonlar ile onkojenik aktivasyon, birlikte, CSCs’ne plastisite sağlayan ve en sonunda da metastaza yol açan en temel mekanizmalardan kısmi epitel-mezenkimal dönüşüm (EMT)’ü uyarma yeteneğine sahiptir. Bu yüzden; gelişim esnasında hücrenin kaderini belirleyen çeşitli sinyal yolaklarının altında yatan temel kök hücre mekanizmalarına dair bilgilerin aydınlatılması, kök hücre bazlı yenileyici tıp ve kanser karşıtı stratejilerin geliştirilebilmesi için elzemdir.
Bu bölümde, CSCs hakkındaki güncel gelişmeleri öne çıkarıp prostat ve akciğer CSCs’nin biyolojik niteliklerini ve niceliklerini ve onların terapi, tümör gelişimi ve metastaz üzerindeki etkilerini tartıştıktan sonra normal kök ve öncül hücreleri hakkındaki bilgilerimizi bir özet şeklinde sunduk.
ANAHTAR KELİMELER
Prostat kanseri / Akciğer kanseri / Kanser kök hücreleri / Metastaz / Kanser kök hücre belirteçleri / Sinyal yolakları / Kısmi epitel-mezenkimal dönüşüm (EMT) / İlaç direnci
GİRİŞ
Kanser, Dünya genelinde ölümün başlıca sebeplerindendir. Bütün kanser türleri içerisinde en çok hayati tehlike yaratan akciğer kanseridir. Akciğer kanseri, kanserin sebep olduğu ölümlerin %20’sini oluşturur. Bu ölümler, büyük çoğunlukla tanının geç konulmasından kaynaklanmaktadır. Bu kanser çeşidi, tüm kanser türleri arasında en çok ölüm oranına sahip olması sebebiyle pandemi olarak tıp dünyasında yerini almıştır. (Bkz. kanserden ölen her dört kişiden birinin yaşadığı ağır sosyal ve finansal sonuçlar [1]) Akciğer kanseri, patolojik özelliklerine göre iki ana grupta sınıflandırılır: (a) akciğer kanserlerinin %20’sinde olan küçük hücreli akciğer kanseri (SCLC) ve (b) geri kalan %80’indeki küçük olmayan hücreli akciğer kanseri (NSCLC). NSCLC’nin; büyük hücreli karsinoma, adenokarsinoma ve sadece %17.8 oranında beş yıllık yaşam olanağı sunan ve her geçen yıl bu oranın yeni tanılarla iyice düştüğü yassı hücreli karsinoma gibi oldukça ölümcül alt grupları vardır [2]. Günümüzde, normal hücrelerin genleri üzerinde yapılan beşeri değişikliklerin malign fenotipe yol açtığı su götürmez bir gerçek. Ayrıca; çeşitli teoriler, kanserin kökenini izah etmede bilime katkı sağlamıştır. Kanser kök hücreleri (CSCs); yüksek oranda tümör oluşturma potansiyeli, bazı spesifik belirteç ve genleri tanımlayabiliyor oluşu, kemoterapiye karşı direnç göstermesi ve yüksek göç ve istila gibi özellikleriyle kansere tohum oluşturmakla kalmayıp normal kök hücreleri ile farklılaşma kapasitesi (asimetrik hücre bölünmesi), kendini yenileyebilme özelliği ve yaygın sinyal yolaklarını ortak olarak kullanabilmesi gibi bazı özel donanımları da paylaşır. Daha önce yapılan açıklamalara binaen CSCs popülasyonu, iyileşmekte olan hastalığın tekrar eski hâline dönmesinin başlıca sebebi olmuştur. Buna ek olarak, günümüzde akciğer kanseri ile baş etmede kullanılan ameliyat, kemo-, radyo- ve hedefli terapi gibi iyileştirici yöntemlerin önüne set koymuştur.
Ana kanser türlerinden bir diğeri prostat kanseridir (PCa). PCa, erkeklerde en çok görülen kanser çeşidi olmakla birlikte Birleşik Devletler ve Avrupa’da kansere bağlı ölümlerin en önemli ikinci sebebidir [3]. Prostat bezi, her biri kendine özgü belirteçler taşıyan üç temel hücre çeşidinden meydana gelir: luminal (salgı), bazal ve nöroendokrin hücreler. Buna ilaveten, küçük bir ara grup hücresi hem luminal hem de bazal hücre belirteçlerini taşır [4]. Bu hücre grupları, birbirlerinden farklı özelliklere sahiptir. Luminal epitel hücrelerinin büyük çoğunluğu androjen reseptörünü (AR) oluşturur (Sinyal devamlılığında gereklidir.), prostata özgü antijen (PSA) ve prostatik asit fosfatı (PAP) salgılar. Bazal epitel hücreler ise AR- olduklarından dolayı kastrasyon için elverişli değildir [5]. Luminal epitel katmanında nadir de olsa nöroendokrin hücreler vardır ve prostat epitelinin %1’inden daha az bir kısmını oluşturacak şekilde prostat bezinde mevcuttur.
Yüksek dereceli prostatik interepitelyal neoplazi (HGPIN), önce lokal olarak invazif karsinomaya ve sonra da metastaz yapan kansere evrilen prostat kanserine yol açar [6]. Erken dönem PCa hücreleri, farklılaşmış AR+ ve PSA+ glandular yapılarını içerir. Buna karşın, az farklılaşmış ya da hiç farklılaşmamış hücreler genel bağlamda AR ve PSA üretimi bakımından negatiftir. Tüm bunlara ek olarak, apayrı alt gruplar da rapor edilmiştir. (Bkz. PSA+ AR+, PSA+ AR-, PSA- AR+ ve PSA- AR-) [7]
KANSER KÖK HÜCRELERİNİN DOĞASI İnsan CSCs’nin karakterize edilmesi ve tanımlanması için göz önünde bulundurulan birçok özellik vardır: (a) farklılaşma kapasitesi, (b) kendini yenileyebilmesi, (c) immün yetersiz bölgelere aktarılan CSCs’nin ikincil veya üçüncül tümör yapıları… [8] Figür 4.1, kanser kök hücrelerinin farklı niteliklerini göstermektedir. Tümörler, tıpkı normal hücreler gibi, birbirlerinden apayrı fenotipik ve morfolojik özellik gösteren ve farklılaşıp çoğalabilen farklı popülasyonlardan meydana gelir [9]. Bir tümörün içindeki hücreler birbirlerinden farklı ve bağımsız gelişim gösterirler. Öyle ki, bazı hücreler hücre döngüsüne giren/girmeyen tümör hücreleri ve bazılarıysa uyku hâlindeki hücreler adı altında sınıflandırılmıştır [10]. Bu yüzden, spesifik CSCs’ni hedeflemek hummalı bir çalışma gerektirir çünkü tümörlerin bu heterojen dağılımları, sadece akciğer kanserinde saptanan CSCs’nin akciğer belirteçlerinin imtiyazlı yardımlarını gereksinimdirir.
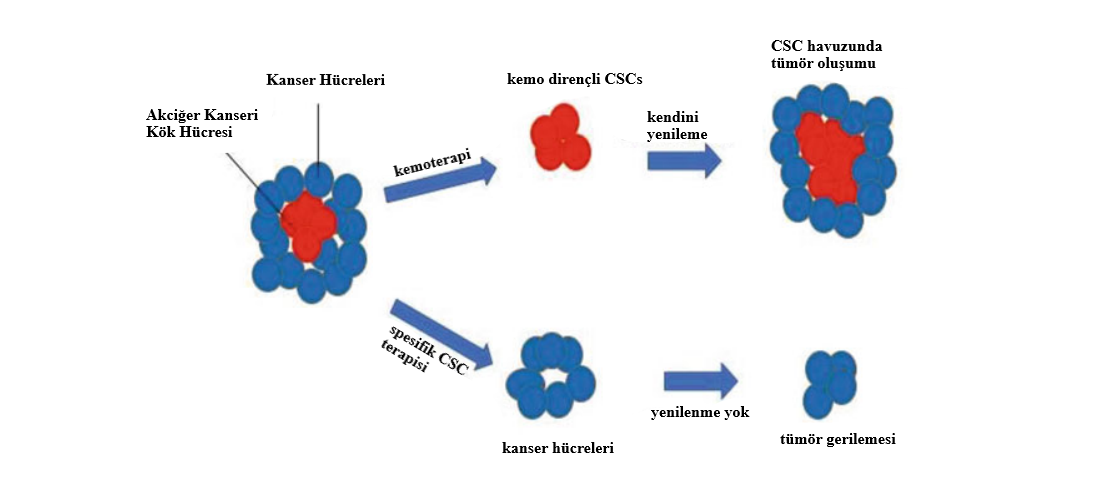
Figür 4.1 Kanser kök hücreleri (CSCs). Kırmızı olan CSCs, havuz oluşturmak için tümör içinde tersine farklılaşıp olup kendilerini yeniler. Mavi, tümörojenik olmayan kanser hücreleri ise kısıtlanmış çoğalma yeteneğine sahiptir. Tümörün gelişimiyle birlikte, CSCs ya benign bir büyüme sergiler ya da kemoterapiye karşı dirençli olup kansere yol açan malign yayılımlar oluşturur.
Akciğer kanseri, akciğer CSCs tarafından üretilen ve aynı dokuda dahi farklı histolojik ve genotipik özellikler taşıyan tümörlerin hasebiyle üzerine daha çok keşif yapılması gereken en karmaşık kanser tipidir. Akciğer kanserindeki CSCs’nin kökeni üzerine öne sürülmüş sav birçok yapıyı içinde barındırır: havayolu kök hücreleri, bazal/mukoza salgı bronkiyal öncül hücreler, nöroendokrin öncül hücreler ve bronşiyol alveolar öncül hücreler… Tüm bu yapıların varlığı, bölgeye özgü akciğer kanseri veya spesifik CSCs’ne atfedilen kanser alt grupları gibi kavramların ortaya çıkmasına neden olmuştur [11].
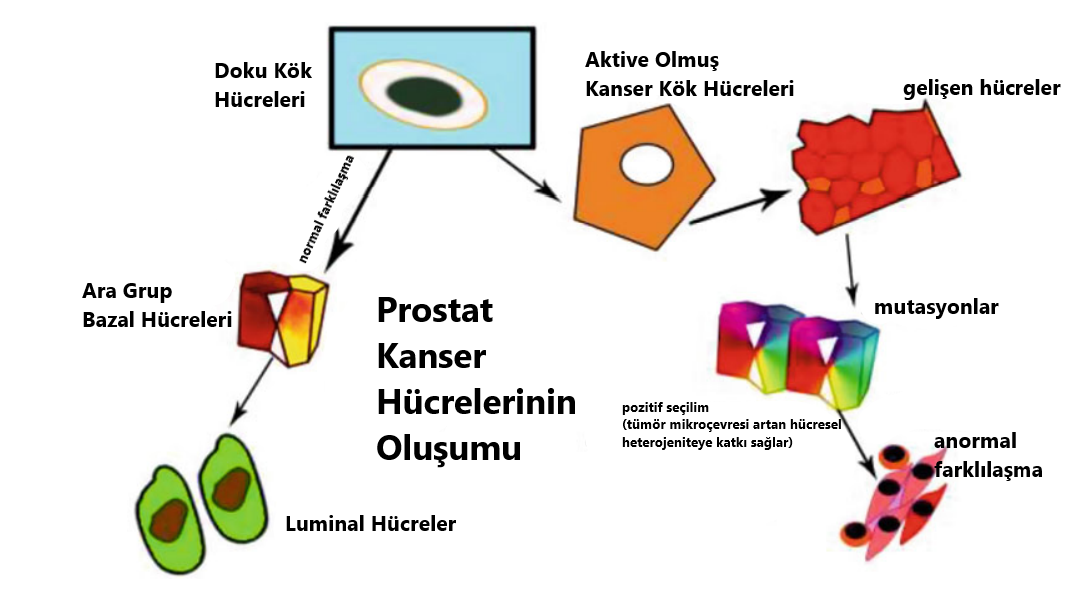
Diğer kanser türlerine benzer olarak prostat kanseri de heterojen bir dağılım sergiler. Çeşitli hücre gruplarının yanında küçük bir hücre popülasyonu, PCa oluşumu ve gelişiminde hayati bir rol oynar. Bu grup, PCa’nin ilerlemesine ve heterojen bir hücre kitlesinin oluşmasına yol açar. Bu özel popülasyon PCa kök hücreleri (PCSCs) olarak tanımlanmıştır. Figür 4.2’de belirtildiği gibi, prostat bezinin bazal katmanında bulunan normal kök hücreler, prostat kanseri kök hücrelerinin oluşmasına zemin hazırlar. Normal şartlar altında, daha sonra olgun salgı hücrelerine dönüşecek olan ikinci popülasyon, kök hücreler tarafından üretilir [12]. Normal kök hücrelerin karsinogenez sırasında mutasyonlar geçirip metastaz yaptığı ve kanser kök hücreleri ile yüksek derecede tümörojenik hücrelerin oluşumuna yol açtığı önceki literatürlerde öne sürülmüştür [13]. Buna rağmen, prostatta bulunan bazal alt grup hücrelerinin sayısı bir kenara, hangi hücre grubunun öncül kök hücreleri içinde barındırdığını tespit etmek hâlâ oldukça meşakkatli bir iştir. Goldstein ve ekibinin yaptığı bir araştırma [14], bazal hücrelerin iki alt popülasyonunun belirli belirteçlerle ayrıştırıldığını rapor etmiştir: Yüksek Trop2 değerlerinin sadece bazal hücreler tarafından üretilebilir ve insan ile fare prostatında kök hücre doğası kazanır. CD133’ün (Prominin-1 olarak da bilinir.) üretimi ise erişkin insan prostatındaki kök hücre popülasyonlarının bir özelliğidir [15]. Benzer şekilde Wang ve ekibinin yapmış olduğu çalışmalar ise labaratuvar ortamında kendini yenileyebilen, renal greftlerde prostat oluşturabilen ve kastrasyondan zarar görmeden çıkan (CARNs: kastrasyon dirençli Nkx3.1 üreten hücreler) luminal hücre grubunu tanımlamıştır [16]. Günümüzdeki senaryoda tartışılan konu hangi alt popülasyonun PCa hücrelerinin gerçek kökeni olduğudur. Histopatolojik verilerin yaklaşık %95’i, tedavi edilmemiş birincil PCa’nin (adenokarsinoma) büyük kısmının luminal AR ve PSA üreten hücrelere ve bir kısmının ise nadiren de olsa bazal benzeri hücrelere mahsus olduğunu ortaya koymuştur [4]. Bu yüzden normal prostat luminal hücreleri PCa için onkolojik dönüşümlerde tetikleyici olarak görev alabilir. Shen’in grubu ise farenin PTEN grupları silinmiş prostat hücre modelinde, senaryonun kastrasyondan sonra yüksek kalitede PIN ve karsinomaya yol açtığını gözler önüne sermiştir [16]. Tüm bunlar ele alındığında ise yapılan çalışmalar, prostat luminal hücrelerin PCa’nin kökeni olduğunun altını çizmektedir. İlginç olan ise güncel bir araştırma, insanın prostat bazal hücrelerinden türeyen ve integrin α2β1 üreten kanserle bağlantılı fibroblast hücrelerinin tümör greftlarini yeniden canlandırdığını göstermiştir [17]. Tüm bu kanıtlar, hem insan hem de fare prostat bazal hücrelerinin PCa’nin kökeni olabileceğini destekler. Figür 4.2 prostat kanser kök hücrelerinin üretimini tasvir etmektedir.
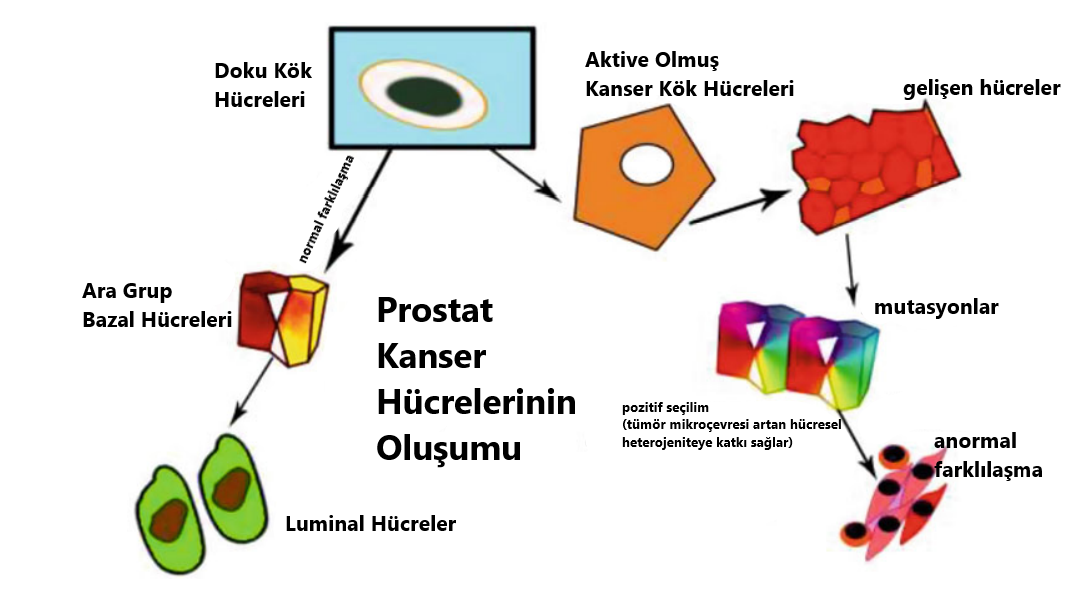
Figür 4.2 Bu figür luminal ve kanser kök hücrelerinin gelişimsel farklılıklarını ortaya koymaktadır. Doku kök hücreleri, luminal hücre olma yolunda farklılaşma geçirir. Kök hücreler, çeşitli tümör baskılayıcı yolaklardan kaçmak için kendilerini yenileyebilmek adına kanser kök hücrelerine dönüşür. Çeşitli genlerde meydana gelen mutasyonlar, düzensiz karakteristiğe yol açar. Daha sonra ise hücreler tersine farklılaşır ve kontrol edilemez bir bölünme sürecine girer.
CSC’NİN KÖKENİ VE BİYOLOJİSİ
Kanser kök hücrelerinin kökeni ve kanserdeki spesifik görevleri üzerine ortaya atılmış birçok teori vardır: hücre füzyonu, horizontal gen transferi, hücre mikroçevresi ve mutasyonları, otoreaktif T hücreleri… [18]
Hücre füzyon teorisi, tümör hücreleri ile kemik iliğinden türetilen hücrelerin (BMDC) füzyonundan meydana gelen CSCs’ni açıklar. Bu hibrit BMDCs, kronik inflamasyon ile doku stresinden ortaya çıkarlar ve radyoterapi dirençli olmakla birlikte bu hücrelerin gelişmiş bir onarım sistemleri vardır. Bu olgu, canlı üzerinde yapılan hayvan modellemesinin sonuçlarınca desteklenmiştir [19].
HGT teorisi, elverişli alıcı hücre bulana kadar ökaryot hücrelerin dışında dolaşabilen DNA’yı ele alır. CSCs; çevresel karsinojenler, kalıtım, DNA replikasyonundaki hatalar ve HGT direnci vasıtasıyla daha fazla genetik değişime yol açabilir [20].
Hücre mikroçevresi; ekstrasellüler matriksi (ECM), komşu hücreleri, hormonları ve hücre ortamı ile hücrenin performansını direkt olarak veya dolaylı yoldan etkileyen hareketleri içinde barındırır [21]. Kök hücrelerin mikroçevre üzerindeki kontrolleri, hücrenin çevikliğinin korunması üzerinde önemli bir role sahiptir. Bu kontrollerdeki herhangi bir yanlışlık, hücrelerin tersine farklılaşması sonucu kansere sebebiyet verebilir. Bazı raporlara göre; bağışıklıktan sorumlu mikroçevre, prekanser lezyonlarının gelişiminde ve tümörogenezde teşvikleyici rol üstlenir. Tümör mikroçevreleri ise tümör heterojenitesi ve kemoterapi direncini dolaylı yoldan etkileyen faktörleri içinde barındırır [22].
Otoreaktif T hücreleri, eğer ki konak hücrenin zayıf bağışıklığında bir açık yakalayabilirse CSCs’nin oluşumuna sebep olabilir [23]. Bu konsept, bizlere bağışıklık sistemini yok etmekten ziyade artırmak yönünde uğraşmamız gerektiğinin sinyallerini vermektedir.
AKCİĞER KANSERİNDE KANSER KÖK HÜCRELERİ
CSCs’nin akciğer biyolojisindeki yeri hâlâ pek de çalışılmış değildir. Yine de CD133, aldehit dehidrojenaz 1 (ALDH1), CD44, CD117, CD87 ve yan popüllasyon (Hoechst negatif) gibi antikanser terapilerine dirençli bazı belirteçler üzerinde çalışmalar yapılmıştır. CSC belirteçlerinin fenotipteki çeşitliliği ve tümör içi heterojenite ile plastisiteden dolayı yine yeni yeniden hücre yüzeyinde nüksedişleri, yeni akciğer CSC belirteçlerinin keşfinin önüne taş koymuştur.
CSCs’NİN İBRAZINDA KULLANILAN FARKLI YÖNTEMLER
CSCs’nin izole edilip tanımlanması, yan popülasyon (SP) gibi işlevsel deney tahlili ve CSC yüzey belirteç üretimi sayesinde yapılır.
SP analizinde hücreler, ATP bağlayıcı kaset (ABC) taşıyıcıları yoluyla DNA bağlayıcı boyayı (floresan Hoechst) kusma potansiyellerine göre ayrıştırılır [24]. Akciğer kanserinin hücre katmanından alınan SP hücreleri, SP grubuna dahil olmayan hücrelere kıyasla invazif etki gösterirler ve tümör oluşturma potansiyelleri daha çoktur, ABCG2 ve diğer ABC taşıyıcılarını yüksek derecede üretirler, birçok kemoterapi ilacına karşı dirençlidirler ve kendilerini yenileme özellikleriyle yüksek oranda çoğalma potansiyeline sahip uçan küreler üretirler [25].
Bir tümörün içinde, diğer hücrelerden ayrılan birçok CSC’nin üzerine yapılan araştırmaların bolluğuna rağmen günümüze kadar sınırlı sayıda CSC belgelenmiştir. Çoğu CSC aynı anda birden çok belirteci üzerinde bulundururken tablo4.1’de de belirtildiği üzere bunlardan yalnızca birini kendini özgünleştirmek adına kullanır ki bu durum hiç gelecek vadetmez.
CD133, glikoz eklenmiş iki büyük hücre dışı halkasal oluşuma ve beş adet ise transmembran yapıya sahip olan bir hücre yüzeyi glikoproteinidir. Sinir sistemi ve hematopoetik sistem için belirgin bir kök hücre belirteci olarak kabul edilir. CD133+ hücrelerin ilaç toleransı, tümör oluşumu ve kendilerini yenileyebilme özellikleri bakımından daha etkin kapasiteleri vardır. Chen ve ekibinin yapmış olduğu bir başka çalışmada, akciğer kanserinden türeyen CD133+ hücrelerindeki Oct-4 üretiminin kanser kök benzeri yapıların devamlılığına yol açtığı saptanmıştır. Oct-4 salınımı, genelde gastrülasyon öncesi embriyodaki pluripotent ve totipotent kök hücrelerde görülür. Bu yüzden; bu durum, akciğer kanserinden türeyen CD133+ hücrelerdeki kanser kök benzeri yapıların ve kemo ile radyoterapiye karşı direnç özelliklerinin mevcut olmasının kritik öneminin altını çizer [26].
GPI bağlantılı glikoprotein CD90 (Thy-1) üretimi, öncelikli olarak lökositlerde gözlemleniyor olsa da hücre matriksinde ve hücre-hücre bağlantılarında da mevcuttur. Yan ve ekibinin yapmış olduğu deneysel bir çalışmada; CD90, akciğer CSCs’ni bulmak için bir belirteç olarak kullanılmıştır ve hücre katmanlarında daha dayanıklı çoğalma, kendini yenileyebilme ve yüksek oranda üretim bakımından deliller ortaya konmuştur [27].
Bir diğer membran bağlantılı glikoprotein CD40’tır. İlk olarak; hücre adezyonu, hücre-matriks etkileşim düzenlenmesi ve hücre göçünde önemli bir rolü olan kolorektal kanseri için bir CSC belirteci olarak öne sürülmüştür. Bununla birlikte, kanser oluşumu ve gelişimiyle ilgili olan çeşitli sinyal yolaklarıyla ilişkisi olduğu ortaya konmuştur [28, 29]. Ek olarak, CD44’ün kanser hücrelerinin yayılımını ve birçok ilaca karşı dirençlerini artırdığı rapor edilmiştir. CD44+ hücrelerin, akciğer kanser hücrelerinde tümör oluşumuna sebep olan bir belirteç olduğu hem in vivo hem de in vitro ortamda saptanmıştır [30].
CD166, bazı katı tümörlerin belirteci olması hasebiyle her ne kadar bu alanlarda detaylıca incelenmiş olsa da konu akciğer kanserindeki CSC belirteci olma sıfatına geldiğinde eldeki bulgular karın doyurucu değildir. Zhang ve ekibinin yapmış olduğu kapsamlı bir çalışmada CD166’nın akciğer CSCs’nin belirteci olma konusundaki görevi ve NSCLC’de CSC potansiyeli belirtilmiştir [31]. CD166’nın, aynı hücreden izole edilen CD44+ ve CD133+’lara göre kendini yenileme yeteneği ve in vivo tümör oluşturabilme kapasitesi oldukça fazladır. Bu yüzden; CD166, akciğer kanserindeki CSC belirteci olma konusunda araştırılmaya değerdir.
Tablo 4.1 Çeşitli tümörlerdeki CSCs’nin tespitinde kullanılan belirteçlerin listesi

KÖK HÜCRE NİŞİ NEDİR?
Birçok araştırma, CSCs için elverişli olan mikroçevreleri CSC nişi olarak adlandırmıştır. Bu tümör nişi, CSCs için yaşamsal olmakla birlikte kendilerini yenileyebilmesi, dokuları istila edebilmesi ve metastaz yapabilmesi için elzemdir. İlginç olarak, Günnur Güler ve ekibinin yapmış olduğu Fourier dönüşümlü kızılötesi spektroskopi (ATR-FTIR) analiziyle prostat CSCs’nin sıvı hâlinin yapısının ve dinamiğinin protein içeriği, nükleik asit bolluğu (DNA/RNA), değişmiş nükleik asit yapısı ve karbonhidrat içeriği gibi temel hücresel makromolekül yapısı bakımından diğer hücre tiplerine kıyasla farklı olduğu gözler önüne serilmiştir [32]. Collins ve ekibi [33], birincil insan PCa’nden türeyen CD44+/ α2β1 hiCD133+ gibi prostat CSCs’ni tanımlamıştır. Raporlar ayrıca belirtmiştir ki birincil insan PCa’ni köken kabul eden PCSCs, memenin kanser direnç proteini olan ABCG2’yi de üretmektedir. PCSCs, bunlara ek olarak, ölümsüzleştirilmiş insan prostatından ve ksenogreft tümörlerin epitelyal hücrelerindeki hücre yüzey belirteçlerinin sayesinde PCa hücre katmanlarında gözlemlenmiştir. Bu durum ise OCT3/4, BMI1 ve β-katenin gibi kök hücre genlerinin düzenlenmesindeki rolünü ortaya koymuştur.
Mateo ve ekibinin yapmış olduğu güncel bir çalışma [34] ise kanser kök hücrelerinin invazifliğinin, kanser kök hücresi olmayan bir alt popülasyonun tümörojeniteyi ve kanser kök hücrelerinin metastazını artırması yoluyla belirlendiğini tespit etmiştir. Bu yüzden kanser hücre alt popülasyonları, tümör çevresindeki diğer normal hücrelerle, bu hücrelerin yararına iletişim içerisinde olabilmektedir.
AKCİĞER KANSER KÖK HÜCRELERİNİN AKTİVİTESİNİN SİNYAL YOLAKLARIYLA KONTROL EDİLMESİ
Hedgehog yolağı (HH), Notch yolağı ve Wnt yolağı; embriyojenez sürecinde farklılaşmadan ve çoğalmadan sorumlu olsa da CSCs’nin kendilerini yenilemelerinde de önemli bir yere sahiptir.
Hedgehog sinyal yolağı, insan vücudundaki kök hücrelerin homeostazisinde, morfojenezinde ve onarımında görev alır. Yapılan bir çalışmada, bu yolağın hem küçük hücreli hem de küçük olmayan hücreli akciğer kanseri tarafından tetiklendiği keşfedilmiştir [2]. HH yolağı, kimyasal direncini kuvvetlendirebileceği için akciğer kanserinin tedavisinde kullanılan kemoterapide başarısızlıklara neden olabilir. Buna ek olarak, bu yolaktaki mutasyonların devamlılığının, tümörojenik oluşumlara ve CSC ile birlikte kanser gelişimine yol açabildiği gözlemlenmiştir [35]. HH yolağında görev alan üç ligant Sonic Hedgehog (SHH), Indian Hedgehog (IHH) ve Desert Hedgehog (DHH)’tır. Bu ligantların birçok temporal ve uzamsal görünüşleriyle birlikte mitojen olup farklılaşmayı ve hücre bölünmesini uyarma gibi görevleri vardır [36]. Bu yolaktaki anahtar ligand Patched reseptörüdür. Bu reseptör, HH sinyallerinin kökeninin yakınlarında üretilir ve HH sinyalleri olmadığı zaman Smoothened (Smo) olarak bilinen diğer transmembran proteinlerinin aktivitesini baskılar [37]. Bu üç ligandın Patched reseptörüyle kurduğu iletişim sonucunda Smo birikimi nedeniyle GLI ailesinin transkripsiyonel faktörleri tetiklenir ve bu faktörler hücre çekirdeğinin içine girdikten sonra en sonunda figür4.3’te de belirtildiği gibi HH genlerini uyarır.
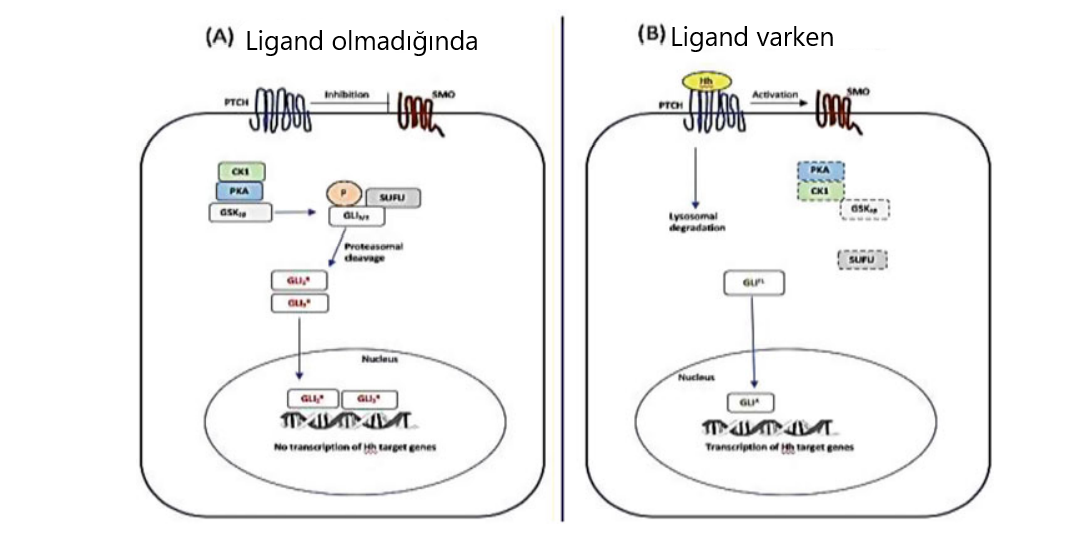
Figür 4.3 Hedgehog sinyal yolağı. (a) Ligand olmadan, patch reseptörü SMO birikimini önler ve PKA, CK1 ve GSK3β tarafından GLI2 ve GLI3 fosforilasyonuna izin verir. Bu moleküller, E3 ubiqutin ligaz β-TrCP için bağlanma bölgesini üretir ve en sonunda baskılayıcı formu (GLI3/2R) oluşturur. Bu form, çekirdeğin içine girer ve HH’in hedef genlerinin transkripsiyonunu baskılar. (b) Ligand ile birlikte, patch reseptörü SMO baskılanmasını rahatlatır ve GLIFL (tam uzun form) birikimini sağlar. Dahası, sinyal çağlayanları aktive olur ve çekirdeğin içindeki GLIA (aktif form), HH’in hedef genlerinin transkripsiyonunu indükler.
Wnt sinyal yolağı memelilerin hücrelerinde oldukça karmaşıktır. Wnt ligantları, hücre yüzeyinde bulunan ve Dishevelled protein ailesinin (Dsh) fosforilasyonunu uyaran reseptör kompleksine bağlanır. Bu durumun getirisi olarak da GSK-3 veya glikojen sentez kinaz ve CK1 veya kazein kinaz 1 tetiklenir. Bu tetiklenmenin amacı β-katenin moleküllerinin sitoplazmada yıkımını ve yapımını gerçekleştirmektir ki bu moleküller hücre çekirdeğinin içine girdikleri zaman bazı spesifik genlerin ifadesi için transkripsiyon faktör / lenfoid artırıcı bağlanma faktörü 1 (TCF/LEF) ile etkileşime girer. Daha önceki raporlarda açıkça belirtilmiştir ki Wnt1 ve Wnt2, birincil tümör ve NSCLC hücre tabakalarında gereğinden fazla üretilmektedir [38].
Evrimsel olarak korunmuş olan bir Notch sinyal yolağı, normal doku gelişiminde ve homeostazisinde farklı bir rol oynar. Bu yolak, insanlarda dört reseptör (Notch1-4) ve beş ligandı (JAG1, JAG2, DLL1, DLL3 ve DLL4) içinde barındırır. Birçok kanıt ortaya koymuştur ki Notch yolağı kanser ile bağlantılıdır ve bu bağlantı ise Notch1’deki bir mutasyonla T hücreli lösemiye sebep olabilir. Ayrıca, bu yolaktaki çeşitli faktörler katı tümörlerin gelişiminde ve metastazında öne çıkar [39].
PROSTAT KANSER KÖK HÜCRELERİNİN AKTİVİTESİNİN SİNYAL YOLAKLARIYLA KONTROL EDİLMESİ
PCSCs’nin aktivitesini düzenlemekle görevli yolaklara ait kanıtlar yavaş yavaş gün yüzüne çıkmaktadır. Örneğin, bir homedomain transkripsiyon faktörü olan Nanog, PCSC aktivitesi ve tümörojenite için oldukça hayatidir. İlgili çalışmalar, miR-34a’nın CD44+, tümörojenik ve metastazik PCSCs’ni negatif yönde düzenlediğini göstermiştir [40]. PCSC kök hücreleri aynı zamanda NF-κB ve PTEN/PI3K/AKT yolakları tarafından da kontrol edilebilmektedir [41]. Bu yüzden bu PCSC düzenleyicileri, özellikle kastrat dirençli prostat kanseri (CRPC) göz önünde bulundurulduğunda, PCa için tedavi edici araç hâline gelmiştir.
Sinyal iletim yolaklarına dair artan kanıtlarla birlikte PCa kök hücrelerindeki metabolik yeniden programlamanın prostat kanserinin gelişimindeki ayırt edici işaretlerden biri olduğu saptanmıştır. Prostat tümörlerindeki kanser bağlantılı fibroblastlar (CAFs), stroma ve tümör hücrelerindeki ortak metabolizmanın yeniden programlanmasını artırıcı yönde görev yapar. Bu görev, CAFs’ın metabolizmasında laktik asit üretimi ve salgısı ile artırılmış glukoz taşıyıcı GLUT1 aktivitesi sebebiyle glikolize doğru kayar. Bunun karşılığı olarak ise CAF tarafından üretilmiş laktat, tersine Warburg etkisi olarak da bilinen metabolik faaliyette, PCa hücrelerindeki aerobik solunumda ve mitokondrilerdeki biyogenezde tetikleyici olarak görev alır. Bununla birlikte, GLUT1 taşıyıcı üretimi seviyesinde gerilemeye sebep olurken laktat üretimini de etkiler [42]. Birçok raporda, CAFs’ın PCSCs’de gen imzası inflamasyonunun düzenlenmesi yoluyla prostat kanserindeki EMT ve kök hücreliliği indüklediği savunulmuştur. Tüm bunlara ek olarak, kronik inflamasyon, agresif prostat kanserinde kilit bir rol oynamaktadır [43].
Hücresel enerji metabolizmasının yeniden programlanması; tümör oluşumu, gelişimi ve bu tümörlerin terapiye karşı direnç gösterme yeteneği için elzemdir. Sağlıklı epitel hücreleri ile kıyaslandığında, PCa hücrelerinde AR sinyalleri tarafından kontrol edilen ve oksidatif fosforilasyonu (OXPHOS) takiben yüksek oranda sitrat oksidasyonu gözlemlenir [44, 45]. Yüksek enerji ihtiyacını karşılamak adına, kontrol edilemez bir şekilde çoğalan tümör hücreleri aynı zamanda Warburg etkisine de kapılırlar. Tüm bunlara ek olarak, mitokondriyal DNA’da ve PTEN ve TP53 gibi tümör baskılayıcı genlerdeki mutasyonlar, OXPHOS’tan aerobik glikolize bir metabolik geçişe neden olur [46]. Bu metabolik yeniden programlanma, embriyonik kök hücrelerin ve PCSCs’nin devamlılığı MYC üretiminde bir artışa ihtiyaç duyar [47]. Yapılan son araştırmalar MYC’yi hedeflemenin PCSC’nin devamlılığını ve tümörojenitesini baskıladığına ışık yakmıştır [48]. Figür4.4 bu durumu, şematik hâlde temsil etmektedir.
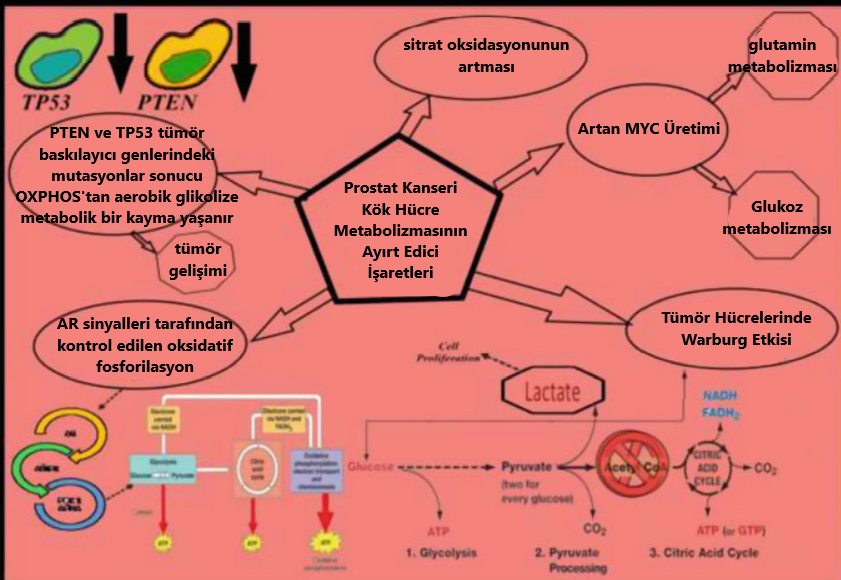
Figüre 4.4 Hücresel enerji metabolizmasını yeniden programlamanın tümör oluşumu ve gelişimindeki hayati rolünün detaylı bir tasviri. Sitrat oksidasyonu ve AR sinyalleri, mitokondrideki oksidatif fosforilasyonu düzenler. Tümör hücreleri hücre bölünmesini iyileştirmek adına Warburg etkisine kapılır. Buna ek olarak, mitokondriyal DNA ve PTEN ile TP53 gibi tümör baskılayıcı genlerdeki mutasyonlar, metabolik bir kaymaya sebep olur ki bu değişim, tümör gelişimini hızlandırır. MYC’nin üretiminin fazla olması ise glukoz taşıyıcısı GLUT1’i çalıştırır ve laktat üretimini sağlar. Bunun yanında glutamin metabolizmasını da kontrol ederek malat üretir ve işleyerek pirüvat ve laktat oluşumunu destekler.
Epitelyal-mezenkimal dönüşüm (EMT), epitel dokunun göç etmeye daha yatkın olan (Bu durumun sebebi E-cadherin gibi epitelyal belirteçlerdir.) mezenkimal dokuya dönüşüp kendisine mezenkimal-spesifik donanımlar kazandırmasının (bkz. vimentin, fibronektin, N-cadherin) bir işaretidir. EMT, embriyojenezde ve yara onarımında hayati bir süreçtir ve yapılan yeni araştırmalar bu sürecin metastaza ve tümör gelişimine yol açan bir dönüşüm olduğunu rapor etmiştir [49]. Artan kanıtlarla birlikte EMT’nin PCSC düzenlenmesinde, metastaz kabiliyetinin gelişmesinde ve PCa hücrelerinin tedavi dirençlerinin oluşmasında kritik bir rol oynadığı onaylanmıştır [50].
İlerlemiş prostat kanserine sahip olan birçok hastada kemik metastazı da gözlemlenmektedir. Bu durum, kemik mikroçevresinin prostat tümörüne bağlanan ve onun hayati fonksiyonlarını idame ettirip gelişmesinden sorumlu olan geniş çaplı bir sitokin ve büyüme faktörü yelpazesini ortaya çıkarmasından kaynaklanmaktadır [51]. Bunun karşılığı olarak da kemik PCa hücreleri ise IL-1, IL-6, paratiroid hormon bağıntılı protein (PTHrP) ve osteoklast oluşumunu ve kemik matriksinin yeniden emilmesini aktive eden PSA gibi pro-osteolitik faktörleri oluşturur [52]. Kansere bağlı ölümlerin %90’dan fazlasının sebebi olarak gösterilen metastaz, günümüzde aşılması gereken bir zorluk olarak kanser araştırmalarında yerini korumaktadır. Stromal hücrelerden türeyen faktör-1 (SDF-1) ve kemokin reseptör (CXCR4), PCa metastazını kemiğe yönlendirir. İnsan prostatının hTERT ile ölümsüzleştirilmiş CD133+ epitel hücrelerinde, CXCR4 üretiminin artmasıyla birlikte kök hücresel yapı oluşumu gözlemlenmiştir.
Yapılan son araştırmalardan elde edilen kanıtlar birleştirildiğinde CSC’nin genel rolü ve PCSC’nin metastazda bir tohum olarak görev alması, SDF-1/CXCR4 bağlamında gözler önüne serilmiştir. İlginç olan ise kemik iliği, karaciğer, akciğer ve lenf nodları gibi metastazın yaygın olduğu organlarda SDF-1 seviyesinin normalin çok üzerinde olduğunun saptanması olmuştur.
CRPC, büyük klinik sorunlardan birisidir çünkü bu kanser çeşidinin altında yatan mekanizmalara ışık tutmak oldukça zordur. Öte yandan; PCSCs, CRPC gelişimini gün yüzüne çıkarabilir. AR ile AR sinyallerinin, AR’den bağımsız ve hayati yolaklarının, CRPC’nin ortaya çıkmasında payları vardır [53]. PCa kök hücreleri radyo-, kemo- ve hormonoterapiye karşı dirençlidir. Tam da bu sebepten, kanserin nüksetmesinin nedeni, farklılaşmamış kanser kök hücrelerine dokunmayıp farklılaşmış olanları öncelikli olarak öldürmek olabilir. CRPC gelişiminden sorumlu çeşitli mekanizmalar, büyük çoğunluğu AR sinyal yolağını merkez alacak şekilde açıklanmıştır. Sonuç olarak, AR sinyallerinin disregülasyonu PCa araştırmalarında ilgi odağı hâline gelmiştir.
Post androjen yetmezliği tedavisine rağmen tümörün tekrar nüksetmesinin altında yatan sebep merak uyandırıcı olmasının yanı sıra çözümlenmesi zor bir gizemdir. Metastazik potansiyele sahip bir tümör tekrarı, EMT fenotipi ile bağdaştırılmıştır. Dahası, EMT fenotipi ise androjen yetmezliği terapisinin uygulamasıyla ilişkilidir [54].
CSCs’ni direkt olarak hedef alabilen daha etkili ve güvenilir bir tedavi, ileri düzey PCa için temel bir ihtiyaçtır. İlginç olarak, metformin –tip2 diyabet tedavisinde oral olarak kullanılan bir ilaç- antikanser etkileriyle de gündeme gelmiştir. Metmorfin, mitokondride oksidatif fosforilasyonla elde edilen ATP’nin azaltılmasına yönelik çalışır çünkü bu enerji Liu ve ekibinin yapmış olduğu bir araştırmaya göre CSC enerjisinin temel kaynağıdır [48].
ZORLUKLAR VE BAKIŞ AÇILARI
CSC ilgi odağı olmaya devam ederken üzerinde yapılan çalışmalar PCa ve akciğer kanseri gibi çeşitli tümör sistemlerini içinde barındırır. Kanser tedavi bilimini geliştirmek adına uygulanan stratejilerden biri de yetersiz tanıyla doğrudan bağlantılı olduğu için akciğer CSCs sorunuyla başa çıkmaktır. Öyle ki, akciğerdeki bariz CSC alt popülasyonunu saptamada CSC heterojenitesi günümüzde büyük tabulardan biri hâline gelmiştir çünkü bu yapı, farklı çalışma prensipleri olan çeşitli morfolojilere ev sahipliği yaptığı gibi akciğerdeki sıvının dengesini korumada, gaz alışverişini düzenlemede, yabancı maddelerin arındırılmasında ve hasar nedeniyle oluşturulması gereken bağışıklık tepkilerini ortaya çıkarmada görevlidir [55]. Dahası, CSCs’nin tespitinde her zaman elverişli yüzey belirteçlerinin varlığına güvenmek pek de doğru bir davranış olmaz çünkü bu belirteçler bazen CSC’ni etkilemede nokta atışı yapamayabilir. Nitekim bu olgu, CD133+ ve CD133-‘de ortak bulunan bir belirtecin kendini yenileyebilme, farklılaşma, koloni oluşturma ve istila edebilme gibi benzer CSC özellikleri gösterdiği yapılan bir araştırma tarafından açıkça ortaya konup desteklenmiştir. Ek olarak, hücrelerin heterojenitesi ve çeşitli genomik yolaklarda kendilerine yer bulabilmeleri CSCs’nin hedeflenmesinin önüne engel koyabilir. Tam da bu yüzden, elimizdeki bulgular, CSCs’ni baskılamada kullanılan seçili yöntemleri saptama konusunda bize çok da yardımcı oluyor değildir çünkü CSCs ve normal kök hücreler birçok özelliği birlikte gösterir ve CSCs’ni hedeflemek, aynı anda normal kök hücreleri de etkileyebileceğinden insan sağlığı için tehlikeli sonuçlar doğurabilir.
Benzer olarak, PCSC’nin kendi düzenleyicileriyle birlikte işlevsel ve fenotipik özelliklerinin etraflıca anlaşılması, PCa’nin gelişimindeki mekanizmaların ve etiyolojinin idrak edilmesinde oldukça yarar sağlayacaktır. Bu zamana kadar rapor edilen PCSCs’nin büyük çoğunluğunu, ksenogreft modellerinin, uzun dönemli kültür hücre tabakalarının veya farelerdeki PCa’nin modellemesinin sonuçlarıdır. Bunun bir temellendirmesi olarak, etraflıca karakterize edilmiş çeşitli ksenogreft modellerde de görüldüğü üzere, spesifik PCa hücre alt popülasyonlarının PSA-/lo, CD44+ α2β1+ ve CD44+ hücreler içeren PCSC aktivitesi nedeniyle geliştiği belirtilmiştir. Günümüze kadar, farklı hastaların tümörlerinin birbirlerinden farklı PCSC yapısına sahip olup olmadığı ve birincil insan PCa’nin tümörojenik kök hücre benzeri kanser hücrelerine ev sahipliği yapıp yapmadığı üzerine sınırlı sayıda rapor yazılmıştır. CRPC, PCa tedavisindeki temel engellerden birini vurgular. Her ne kadar birincil insan PCa örneklerinde kastrasyon dirençli PCSCs’nin varlığına dair bir yargı ortaya konmamış olsa da son zamanlardaki çalışmalar, bazı PCSC alt popülasyonlarının düşük seviyede AR üretebileceğini ve doğal olarak kastrasyona karşı dirençli olabileceğini destekleyen kanıtları ileri sürmüştür. Bu tür hücrelerin çoğalması, uygulanabilir CRPC’nin gelişimini destekleyebilir. Sonuç olarak, kastrasyon dirençli bu PCa hücreleri, yeni ilaçların geliştirilmesinde potansiyel hücresel hedefler hâline gelmiştir. Farklı klinik aşamalarda olan kastrasyon dirençli PCSCs’ni tespit etmek için gelişmiş tümör yapılandırması protokolü ve model sistemlerini içeren bilimsel araştırmalara ihtiyaç vardır ki gelecekte bu emeklerin karşılığı tedavi biliminde, PCa’li hastaların yararına alınabilsin.
SONUÇLAR
Akciğer kanserini kolaylıkla tedavi etmek, kimyasal ilaçlara karşı olan direnç ve kanserin tekrar nüksedebilmesi sebebiyle oldukça karışık bir hâl almıştır. Bu yüzden, CSC gelişiminin ve korunumunun altında yatan temel prensipleri kavramak elzemdir ki kanserin ilerlemesinin, tümörojenitenin ve kemoterapik direncin önlenmesinde çok geç olmadan doğru adımlar atılabilsin. Tam da bu yüzden, modern çağda, CSCs, kanser tedavisinde önemli bir klinik hedef hâline gelmiştir her ne kadar her türlü kanser çeşidinden daimi olarak kurtulmak pek de kolay değilse de. Şu gerçeği aklımızdan çıkarmamalıyız ki her tümör tipi çeşitli moleküler yolaklar tarafından kontrol edilen farklı kök hücre tiplerine ev sahipliği yapar ve bu durum, akciğer kanseri senaryosunda, akciğer kanserinin alt çeşitlerindeki belirteç tezahürünün birbirlerinden farklılık gösterebilmesi sebebiyle daha da karmaşık bir hâl alır. Bu nedenden dolayı bu bölüm; CSC’nin kökenini, özelliklerini, akciğerdeki belirteçlerini, sinyal yolaklarındaki rolünü ve yeni tedavi yaklaşımlarını ele alarak kanser biyolojisi ve bu kök hücrelerin gen ifadesindeki temellerin üzerine derinlemesine bir incelemenin gerekliliğini, verimi artırmak için, hedefe yönelik tedavi ve atomik olmayan tedavinin bir harmanlaması vasıtasıyla gözler önüne serer. Benzer şekilde, yakın zamanda elde edilen kanıtlar, PCa kök hücrelerinin tümörogenezdeki rollerine ilişkin bizi aydınlatmaktadır. Her ne kadar kök hücre terapisi kanser kitlelerindeki hücrelerin heterojenitesinin ardındaki gizemi açıklığa kavuşturmuş olsa da PCa hücrelerinin nitelikleri ve karakteristiklikleri hakkında eksiksiz bir bilgi hâlâ arzulanmaktadır ki PCa kökeni üzerine yeni ufuklar açılabilsin. Bununla birlikte, normal kök hücrelerini kanserojenik olanlardan ayırt edebilmek için gerekli olan belirteçlerin tespit edilmesi zaruri önem arz etmektedir. Öte yandan, gelecek yıllar için en hayati ihtiyaç, kök hücreye yönelik ilaçların yeni ve etkili olması ve kanserde nüksetme tehdidinin azaltılması olacaktır.
KAYNAK: Cancer Stem Cells: New Horizons in Cancer Therapies, Editörler: Surajit Pathak Antara Banerjee